Este artículo titulado ¨ Rizogénesis directa de explantos de hoja de plántulas de naranjilla (Solanum quitoense Lam.) cultivada in vitro ¨ establece un protocolo para rizogénesis directa en hojas de S. quitoense cultivadas in vitro, analizando el rol de auxinas en la formación radical. La técnica desarrollada permite obtener plántulas enraizadas eficientemente, ofreciendo nuevas posibilidades para la propagación masiva de este frutal andino con importancia económica.
Tabla de Contenidos
Introducción
La naranjilla o lulo, es una Solanaceae originaria de los Andes ecuatorianos, de esta fruta climatérica se comercializan diferentes variedades e híbridos constituyéndose como un rubro de importancia económica en el Ecuador, hasta 2002 la Región Amazónica acaparaba el 92 % de la producción total del país, el resto se distribuye en las estribaciones de los Andes, a nivel nacional se alcanzan aproximadamente una 3.56 toneladas por hectárea en cuanto rendimiento en una superficie de cultivo nacional de no menos de 9450 ha.
Actualmente los principales problemas fitosanitarios que tiene el cultivo de la naranjilla son: principalmente punta morada (PMP) producido por Candidatus liberibacter solanacearum (CaLso), patógeno obligado que se localiza en el floema de la planta y es transmitido por el insecto vector Bactericera cockerelli, psílido que infesta las plantas inyectando una toxina y la bacteria al momento de alimentarse, la marchitez vascular (Fusarium oxysporum), la lancha (Phytophthora infestans), el nematodo de la raíz (Meloidogyne incognita) y el gusano perforador del fruto (Neoleucinodes elegantalis), que producen pérdidas que pueden alcanzar hasta el 100 % de la producción (Castro & Herrera, 2019; Viera et al., 2021).
Las técnicas de micropropagación vegetal a partir de explantos, utilizando protocolos de organogénesis directa o indirecta en condiciones in vitro, tienen múltiples beneficios como reducir las pérdidas de plántulas en semilleros, eliminar virus, eliminar descendencia con defectos genéticos, obtener material vegetal sano y de calidad, así como el aumento de probabilidad de supervivencia de plántulas. La organogénesis implica la formación de raíces de manera directa o indirecta, que origina la rizogénesis y la formación de brotes, conocida como caulogénesis. La primera requiere mayor concentración de auxinas; la segunda, de citoquininas.
La organogénesis directa, como su nombre lo indica, se refiere a la formación de nuevos órganos (raíces o brotes) a partir de diferentes partes de la planta (explantos). Se debe seleccionar material de óptima calidad con el fin de obtener resultados satisfactorios, la rizogénesis específicamente, es el proceso por el cual se genera la formación de raíces en un medio establecido, suplementado con auxinas (Martín et al., 2015; Perea, 2009).
El cultivo de tejidos vegetales es una técnica esencial en la propagación de plantas en peligro de extinción o de interés económico (Ojeda et al., 2007). La micropropagación mediante rizogénesis directa (organogénesis directa) constituye una importante opción para la multiplicación de naranjilla o lulo (Solanum quitoense Lam.), especie de interés económico en el Ecuador y otros países del trópico, en este ensayo de laboratorio se indujo dos explantos de hoja de hoja de plántulas de naranjilla (Solanum quitoense Lam.) cultivadas in vitro, en medio MS con ácido naftalenacético (ANA), auxina asociada con al enraizamiento de esquejes de plantas y el crecimiento vegetal.
Objetivos
- Cultivar mediante organogénesis directa in vitro en medio MS + ANA dos explantos de hoja de plántulas de naranjilla previamente cultivada in vitro.
- Discutir a la luz de la literatura los factores que inducen a la contaminación de los cultivos in vitro en cuanto a organogénesis.
- Discutir a la luz de la literatura los factores asociados al cultivo in vitro de tejidos foliares mediante organogénesis directa, con auxinas para inducción de rizogénesis.
Materiales y métodos
Materiales y reactivos
- 1 frasco de vidrio con medio MS con 0.5 ppm de ácido naftalenacético (ANA) previamente esterilizado y herméticamente sellado
- Material vegetal: plántulas de naranjilla sanas, cultivadas in vitro con hojas grandes.
- Pinzas
- Bisturí
- Alcohol al 96 %
- Mechero
- Incubadora
- Cámara de flujo laminar
- Servilletas esterilizadas
- Rotulador
- Papel aluminio
- Parafilm
Metodología
Sitio Experimental: Laboratorio de Biotecnología Vegetal de la Facultad de Ciencias Agrícolas, Universidad Central del Ecuador.
Procedimiento:
- Esterilizar el área de trabajo dentro de la cámara de flujo laminar, la cámara debe estar encendida.
- Retirar el parafilm y flamear el frasco con el cultivo in vitro de naranjilla de donde se obtendrán los explantos de hoja.
- Con las pinzas previamente flameadas, retirar la tapa de aluminio del cultivo de naranjilla del cual se obtendrán los explantos de hoja.
- Repetir la operación (2-3) con el frasco con medio MS + 0.5 ppm ANA donde se sembrarán los explantos de hoja.
- Rociar alcohol en el paquete de servilletas para esterilizar.
- Con un bisturí previamente flameado, abrir un paquete de servilletas esterilizadas y colocarlas en la superficie de la mesa de trabajo de la cámara de flujo laminar.
- Con el bisturí y las pinzas previamente flameadas cortar dos cuadrados de hasta 1 cm2 de hoja de naranjilla cultivada in vitro y colocarlos sobre la servilleta. El cuadrado debe considerar el corte de los bordes laterales, la base y la punta de la hoja de modo que los cuatro lados estén totalmente expuestos al medio.
- Tomar cada uno de los cortes cuadrangulares con las pinzas previamente flameadas y colocarlos con el envés hacia el medio, una en cada extremo del frasco, asegurándose que queden totalmente extendidas tocando donde la superficie de la hoja toque todo el medio.
- Flamear el frasco y la tapa de aluminio, tapar y recubrir con rollopack.
- Rotular el frasco y llevar a la incubadora por alrededor de 20 días en oscuridad.
- Al cabo de 3 a 4 semanas aproximadamente sacar de la incubadora y colocar en las estanterías en la zona de habituación hasta que esté en condiciones de trasplantar a sustrato. El cultivo deberá estar libre de contaminación microbiana.
Resultados
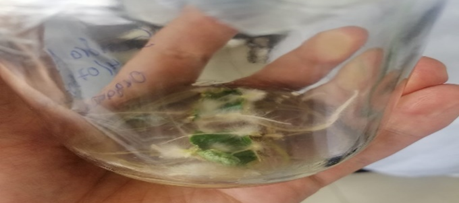
Al cabo de unas 4 semanas se evaluó el estado de los explantos, se identificó que durante las primeras semanas los explantos iniciaron su rizogénesis, sin embargo, el cultivo fue contaminado por lo que aparentemente se trataría de un hongo del género Penicillium sp. por la característica circunforme de verde característico y secreción como se puede observar en la figura 1. Se comparó los resultados con otro cultivo realizado con éxito, como se evidencia en la figura 2, realizado en las mismas condiciones y se evidencia la formación de raíces abundantes sin evidencia de contaminación. La figura 3 en los anexos evidencia el resultado de la siembra en el día en que se estableció el cultivo in vitro.


Discusión
Los resultados obtenidos arrojaron contaminación fúngica por una ruptura en el protocolo de asepsia en la cámara de flujo laminar, los resultados se evidencian en la figura 1, el conocimiento de los microorganismos contaminantes, de las fuentes que lo introducen al cultivo in vitro y de los factores de riesgo, así como la aplicación de métodos para prevenir, detectar y controlar la contaminación puede conducir en el futuro a niveles de productividad cada vez más eficientes y logrará disminuir las consecuencias negativas de este fenómeno (Borges et al., 2003).
La colonia de hongos observada era de color verde azulado con bordes blancos y café pálido hacia el centro, estas características coinciden con las reportadas por Allende et al. (2013), dicha contaminación puede haberse debido a una contaminación cruzada en la cámara de flujo laminar por esporas provenientes del exterior y transportadas en la ropa, cabello, manos, mandiles contaminados, etc.
Dentro de los cultivos in vitro, la organogénesis es una de las técnicas más importantes, puesto que a partir de cualquier segmento de la planta se obtienen los diferentes órganos requeridos para la multiplicación de plántulas. La proliferación puede lograrse con el empleo de sustancias reguladoras de crecimiento como componentes principales en un medio nutritivo.
La organogénesis puede ocurrir a través de dos vías: directa e indirecta. La primera consiste en la formación de órganos a partir del explante seleccionado; y la segunda se refiere a la formación previa de callo y a la posterior formación de órganos. La rizogénesis es el proceso por el cual se genera la formación de raíces en un medio establecido, suplementado con auxinas (Perea, 2009).
Los investigadores Dallos et al. (2010) determinaron que el proceso de rizogénesis directa para el cultivo in vitro de segmentos de hoja de uvilla o uchuva (Physalis peruviana) se requiere medio MS con pH básico con suplemento de auxinas, el ácido naftalenacético (5,71 mM) indujo la emisión de raíces sobre la superficie de las hojas (rizogénesis directa) en condiciones de 17 ºC ±2 y fotoperiodo de 12/12 horas, condiciones similares a las que se sometió el presente ensayo experimental.
Uno de los principales factores a tomar en cuenta en el cultivo in vitro de tejidos vegetales, sin tomar en cuenta la marcada influencia de los reguladores de crecimiento es un medio de cultivo con bajo potencial osmótico como estrategia empleada para una adecuada formación y crecimiento de la raíz. Este se logra disminuyendo los niveles de sales inorgánicas (e.g. ¼ o ½ MS), pues es conocido que altos niveles de las mismas inhiben la formación de raíces (Martín et al., 2015), este procedimiento coincide con los resultados obtenidos por Álvarez et al. (2011) quienes evaluaron el medio MS en concentración ¼, con tres tipos de auxinas (AIA, ANA y AIB), se cultivaron explantos de Gmelina arborea.
Se concluyó que las auxinas en el medio de cultivo es necesaria para aumentar el porcentaje de enraizamiento in vitro plántulas de G. arborea, el ANA 1.0 mg/l , tanto en la caulogénesis como en la rizogénesis. En naranjilla, los autores Soto & Pozo (2016) determinaron que la formación de raíces adventicias se indujo con éxito el medio (MS + 0,5 mg/L ácido indolacético (AIA)) mientras que la formación de callo se indujo con éxito en el medio (MS + 1 mg/L ANA 2 mg/L BAP).
Estos resultados coinciden con los reportados por Criollo (2013) quien reportan que el enraizamiento de los explantes sufrieron una reducción significativa con el incremento de las dosis de ANA, la inducción de raíces en hojas cotiledonares e hipocótilos de lulo sin espinas fue mayor con ANA (19,8 µM).
Además mencionan que estos resultarse pueden inhibirse con un aumento de las dosis de sacarosa en el medio, finalmente concluye que la adición de cinetina, inhibe la acción enraizadora de pequeñas dosis de ANA y reduce el porcentaje de explantes con callo. En solanáceas, especialmente silvestres, la rizogénesis puede estar determinada por origen del explante, donde se ha reportado mayor éxito de rizogénesis cuando se inducen yemas por tener mayor cantidad de tejidos jóvenes (Andrade et al., 2013).
En otros cultivos, como el de piña roja española, se reportan éxitos en rizogénesis directa con la adición del inductor 2,4 -D en medio MS a razón de 2.5 mg por litro, por lo que entre especies los inductores de raíz pueden variar (Pineda et al., 2012). La acción del ácido naftalenacético como inductor de la rizogénesis de los callos in vitro es variable entre especies. En el cultivo de ñame (Dioscorea sp.) las dosis inductoras de raíz en medio MS pueden variar entre 0.6 y 0.9 mg/l donde se obtuvo un buen número de raíces por planta en tres cultivares, también se incrementó la formación de callo y la oxidación del medio de cultivo (Quintero et al., 2003).
Otro factor importante para la rizogénesis es la zona de la hoja a la que se inducirá a rizogénesis, por ejemplo, en Curcuma longa vía organogénesis directa se determinó que los explantos obtenidos de la base de su hoja obtienen mejor y mayor número de brotes radiculares adicionando al medio MS 1.0 mg/L de ANA y BAP (Monsalve et al., 2014).
Este mismo criterio propuesto por Castellanos-Hernández et al. (2006) quienes determinaron para Paulownia elongata una alta totipotencia de las células y/o tejidos cercanos a la base de la hoja, los cuales incluyeron parte del pecíolo cuando se compararon con el tejido central de la hoja. Así, la mayor producción de brotes se obtuvo al utilizar el medio de cultivo MS suplementado con 10 mg·l-1 de BA y 0.5 mg·l-1 de ANA, alcanzando el 80 % de brotes en 4 semanas, este último en la misma concentración empleada en este ensayo.
En Solanum nudum Dunal, se registró un promedio alto de formación de brotes (4,83) en explantes de hoja de plántulas de 5 meses cultivadas sobre medio Murashige y Skoog (MS) a mitad de sales y vitamina cultivados en medio suplementado con 2,0 mg/L de BAP y 0,1 mg/L de AIA, bajo condición de iluminación por un periodo de 30/15 días oscuridad/luz, los autores destacan las propiedades terapéuticas de la planta por lo que su micropropagación tiene potenciales usos en la farmacéutica (Suárez et al., 2011).
Conclusiones
El cultivo in vitro de naranjilla mediante explantos de hoja requiere un proceso de organogénesis directa o rizogénesis directa propiamente, que implica la formación de raíces de manera directa y requiere cierta concentración de auxinas; se debe seleccionar material de óptima calidad con el fin de obtener resultados satisfactorios.
Existen varios tipos de inductores de rizogénesis como lo son el ácido indolacético (AIA), el ácido naftalenacético (ANA), el 2,4 -D, BAP, entre otros, siendo el uso de auxinas el más recomendado para estos fines.
Un cultivo axénico requiere condiciones de asepsia durante y después de todo el protocolo de acción en la siembra de explantos de hoja.
Recomendaciones
Es recomendable el uso y comparación de los otros reguladores de crecimiento (auxinas) que se pueden emplear como se reporta en este documento.
Evitar la contaminación del medio, procurando eludir el uso de instrumentos y recursos no esterilizados.
Referencias
Allende, R., Picos, P., Márquez, I., Carrillo, J., García, R., & León, J. (2013). Identificación morfológica y molecular de Penicillium oxalicum causante de la podrición de tallos y frutos de tomate. Revista Mexicana de Fitopatología, 30, 13–19.
Álvarez, J., Beltrán, D., & Mesa, N. (2011). Evaluación de reguladores de crecimiento vegetal en la organogénesis de Gmelina arborea roxb. Revista Tumbaga, 6, 107–124.
Andrade, D., Córdoba, M., Criollo, H., & Lagos, T. (2013). Vista de Evaluación de medios de cultivo para propagación in vitro de semillas y explantes de especies silvestres de Solanum. Acta Agronómica, 62(1), 27–36. https://revistas.unal.edu.co/index.php/acta_agronomica/article/view/25153/43097
Borges, M., Vázquez, J., & Rodríguez, A. (2003). Preparación de Agar a partir de mosto de destilería y harina de Soya para detectar contaminantes microbianos en cultivos de tejidos vegetales. Bioagro, 15(3), 217–220. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1316-33612003000300009&lng=es&nrm=iso&tlng=es
Castellanos-Hernández, O., Rodríguez-Sahagún, A., Rodríguez-Domínguez, J., & Rodríguez-Garay, B. (2006). Organogénesis indirecta y enraizamiento in vitro de Paulownia elongata. E-Gnosis, 4(15), 1–12. www.e-gnosis.udg.mx/vol4/art15
Castro, W., & Herrera, L. (2019). La naranjilla (Solanum quitoense Lam.) en Ecuador (M. Artiles, Ed.; 1ra Ed., Vol. 1). Editorial Feijóo. https://dspace.uclv.edu.cu/bitstream/handle/123456789/12219/Naranjilla.pdf?sequence=1&isAllowed=y
Criollo, H. (2013). Estudios orientados a la regeneración de plantas de lulo (Solanum quitoense Lam.) a través de la embriogénesis somática [(Tesis previo la obtención del Grado de Doctor en Ciencias Agrarias con énfasis en Fisiología de Cultivos), Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/bitstream/handle/unal/20720/07797058.2013.pdf?sequence=1&isAllowed=y
Dallos, M., Rodríguez, N., Fischer, G., Velásquez, M., & Micán, Y. (2010). Uchuva. Physalis peruviana L. (Solanaceae). In A. Tirado Perea, A. Matallana, & M. Perea Dallos (Eds.), Biotecnología aplicada al mejoramiento de los cultivos de frutas tropicales (1ra Edición, Vol. 1, pp. 466–490). Universidad Nacional de Colombia.
Martín, R., Chong-Pérez, B., & Pérez-Alonso, N. (2015). Organogénesis in vitro en el género Digitalis. Biotecnología Vegetal, 15(4), 195–206.
Monsalve, Z., Urrea, A., & Canal, A. (2014). Organogénesis y embriogénesis en Curcuma longa L. a partir de capas delgadas de células, segmentos y bases de hoja. Revista Colombiana de Biotecnología, 16(2), 74–83. https://www.redalyc.org/articulo.oa?id=77632757009
Ojeda, A., Buendía, L., Orozco, J., Lechuga, J., & Cruz, F. (2007). Rizogénesis in vitro de Obregonia denigrii Fric Cactácea en peligro de extinción. XII Congreso Nacional de Biotecnología y Bioingeniería. https://smbb.mx/congresos%20smbb/morelia07/TRABAJOS/Area_II/Carteles/CII-2.pdf
Perea, M. (2009). Cultivo de Tejidos Vegetales In Vitro (1ra edición, Vol. 1). Facultad de Ciencias, Universidad Nacional de Colombia. http://ciencias.bogota.unal.edu.co/fileadmin/Facultad_de_Ciencias/Publicaciones/Imagenes/Portadas_Libros/Biologia/Cultivo_de_Tejidos_Vegetales_In_Vitro/Cultivo_de_Tejidos_Vegetales_In_Vitro.pdf?fbclid=IwAR2xLhdtU-7yKztpAvuWQjdZYh-ltzpcYT6PnzpAErkw__ZozfqclxwYy-Y
Pineda, A., Vargas, T., Escala, M., & de García, E. (2012). Organogénesis in vitro en piña “Española Roja” y morfoanatomía foliar de las plantas obtenidas en el proceso. Bioagro, 24(3), 175–186. https://ve.scielo.org/pdf/ba/v24n3/art03.pdf
Quintero, I., Polo, J., Jarma, A., & Espitia, A. (2003). Enraizamiento in vitro de Dioscoreas sp. Revista Colombiana de Biotecnología, 5(2), 51–56. https://www.redalyc.org/articulo.oa?id=77650206
Soto, L., & Pozo, A. (2016). Despliegue diferencial de genes candidatos que se activan durante el cultivo in vitro de hipocótilos de naranjilla Solanum quitoense Lam var. quitoense [(Tesis previo la obtención del título de Ingeniera Agrónoma), Universidad Central del Ecuador]. http://www.dspace.uce.edu.ec/bitstream/25000/10095/1/T-UCE-0004-85.pdf
Suárez, O., Naranjo, E., Atehortúa, L., & Blair, S. (2011). Organogénesis directa in vitro a partir de hojas de la planta Antiplasmodial Solanum nudum Dunal. Revista Colombiana de Biotecnología, 13(2), 186–192. https://www.redalyc.org/articulo.oa?id=77621587018
Viera, W., Viteri, P., Martínez, A., Castillo, C., & Peñaherrera, D. (2021). Guía para el conocimiento de la punta morada en tomate de árbol (Solanum betaceum Cav.) y alternativas para un manejo integrado. Boletín Divulgativo No 449. https://repositorio.iniap.gob.ec/bitstream/41000/5762/1/Gu%C3%ADa%20de%20punta%20morada%20de%20tom%C3%A1te%20de%20%C3%A1rbol.pdf
Sugerencia
¿Te gustaría conocer más sobre cómo impulsamos la innovación y el conocimiento desde Eñengi? Visita nuestra página y descubre cómo estamos transformando el futuro a través del e-learning. ¡Haz clic aquí y únete a nuestra comunidad de cambio!







Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.