GUEVARA LÓPEZ ETHAN AARON
GAVILANES CHAVEZ ISAAC MATEO
ZURITA IÑIGUEZ FAUSTO JOSÉ
Universidad de Investigación de Tecnología Experimental Yachay, Escuela de Ciencias Química e Ingeniería (2024).
Contenidos
RESUMEN
En la presente practica se realizaron mediciones de la velocidad de reacción entre el ion peroxodisulfato (persulfato) y el ion yoduro en disolución acuosa para determinar los órdenes de reacción y el coeficiente cinético. Así mismo se utilizó el método de las velocidades iniciales, manteniendo constante la concentración de uno de los reactantes mientras se variaba la del otro. En cuanto a velocidad de reacción se midió por el tiempo que tardaba en desaparecer una cantidad de ion persulfato, utilizando reacciones secundarias para visualizar el punto final mediante un cambio de color provocado por la reacción del yodo con almidón. Calculando las concentraciones iniciales y las velocidades de reacción para obtener los órdenes cinéticos y la constante de velocidad. Los experimentos revelaron la dependencia de la velocidad de reacción con las concentraciones de los reactantes.
Observaciones Experimentales
Se observaron varios cambios cualitativos durante el uso del Reloj de Yodo, que son esenciales para comprender el proceso. Se observó un cambio de color notable cuando la solución cambió de incolora a un tono azul oscuro, lo que indicaba la formación de yodo. Además, se observó un ligero desprendimiento de gases en forma de burbujas, lo que podría indicar una reacción que tiene lugar en el espacio. Además, la mezcla de reacción tenía turbidez, lo que podría indicar la formación de nuevos compuestos o la precipitación de algunos de los reactivos. Estas observaciones son esenciales para el análisis de la cinética de la reacción y los mecanismos subyacentes que rigen el experimento
Introducción
En la termodinámica, se estudia cómo se da el cambio de la energía y entalpía dentro de un sistema, mientras que la cinética química brinda detalles sobre la velocidad y el mecanismo de las reacciones. Esta rama específica se enfoca en el análisis y estudio de cómo factores ya sea químicos o ambientales como lo son la temperatura y concentración de los reactivos y la presencia de catalizadores afectan la velocidad de una reacción. Las velocidades de reacción varían; por ejemplo, la oxidación del hierro es mucho más lenta que la combustión de la gasolina. Este análisis permite a las empresas tomar decisiones rentables al elegir reacciones más rápidas, como la combustión de la gasolina, para lograr resultados óptimos en la comercialización. En esta práctica de laboratorio se estudió una reacción con velocidad intermedia, fácil de medir a temperatura ambiente, lo que la hace ideal para su estudio. Se analizó la reacción entre el ion peroxodisulfato [S2O82-] y el ion yoduro (I–) en una solución acuosa, que produce I2 y el ion sulfato [SO42-].
Resultados y Discusión de Resultados
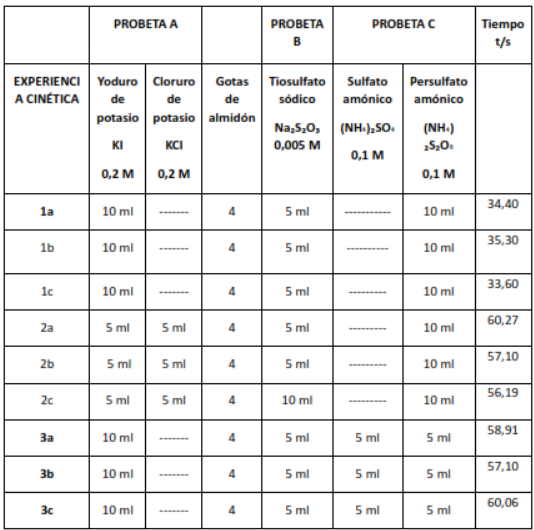
Serie 1 (Probetas A): Contiene sólo KI y KCl con almidón y tiosulfato sódico. Los tiempos de reacción son relativamente cortos, lo que indica que la reacción procede a una velocidad moderada.
Serie 2 (Probetas B): La mitad de la solución es KI y la otra mitad KCl, con los mismos reactivos adicionales que la serie 1. Los tiempos de reacción aumentan significativamente, lo que sugiere que la presencia de KCl en igual proporción que KI ralentiza la reacción.
Serie 3 (Probetas C): Se introduce el sulfato amónico y el persulfato amónico en la mezcla. Los tiempos de reacción son similares a los de la serie 2, lo que podría indicar que estos compuestos no tienen un gran efecto en la velocidad de la reacción bajo estas condiciones. Para presentar los resultados de manera más clara, se pretende calcular la velocidad de reacción para cada probeta utilizando la fórmula:
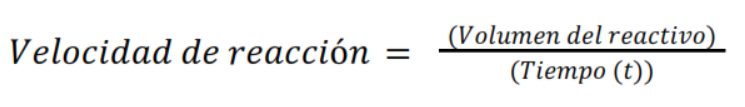
Así mismo se debe comparar las velocidades de reacción entre las diferentes series para determinar el efecto de cada reactivo en la cinética de la reacción. Una observación en cuanto a la práctica es que sería útil realizar pruebas adicionales variando las concentraciones de los reactivos para obtener una comprensión más profunda de cómo afectan a la velocidad de la reacción.
Concentraciones iniciales y velocidad de reacción
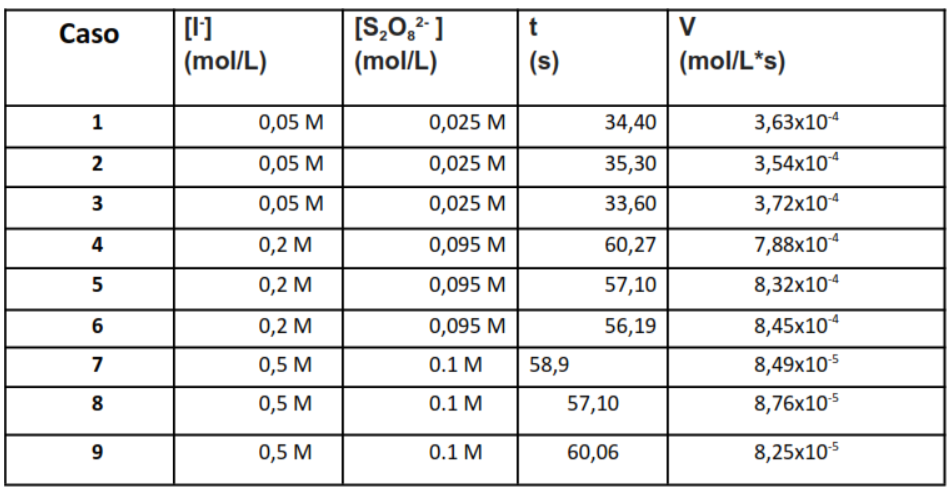
Concentraciones iniciales y velocidades de reacción / tiempo promedio de todos los grupos del laboratorio.
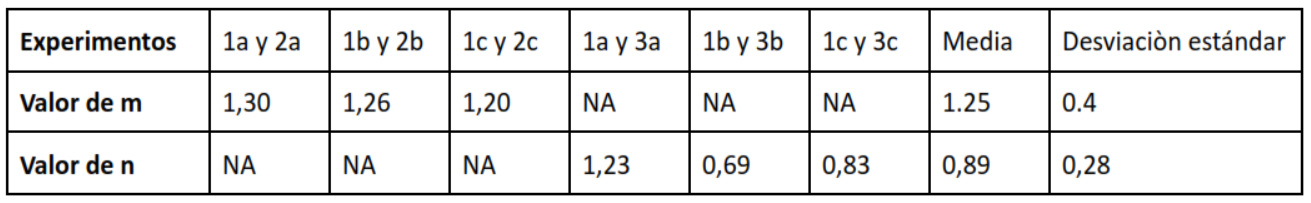
Ahora para encontrar los órdenes de reacción relacionamos las experimentaciones de tal manera para complementar la tabla siguiente.
– m para el orden de [I–]
– n para el orden [S2O82-]
Para encontrar m relacionamos la reacción 1a y 2a, 1b y 2b, 1c y 2c. Con la ecuación siguiente:
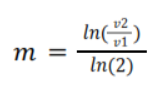
Para encontrar n relacionamos la reacción 1a y 3a, 1b y 3b, 1c y 3c. Con la ecuación siguiente:
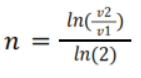
Constante de Velocidad
Para encontrar la constante de reacción utilizamos la siguiente ecuación para todas las
experimentaciones y completamos las siguientes tablas:
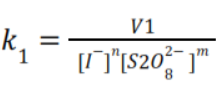
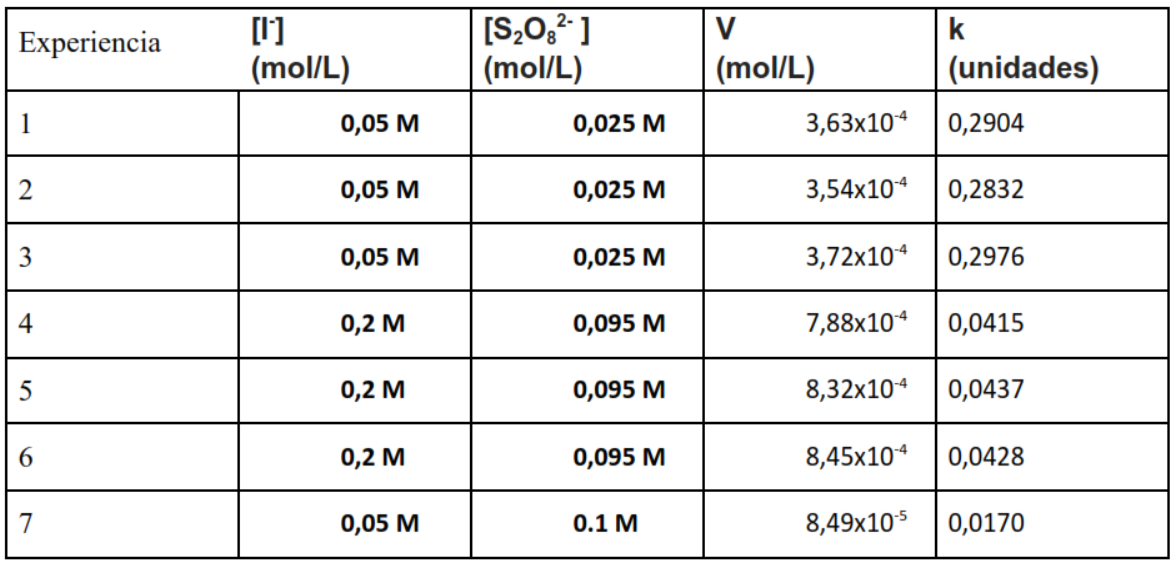

La tabla proporcionada muestra los resultados de varios experimentos de cinética química en los que se midió la constante de velocidad (k) para la reacción entre iones yoduro [I–] y persulfato [S2O82-]. Los valores de (k) se han obtenido utilizando la concentración de los reactivos y el volumen de producto formado (V).
Analizando el material:
Concentraciones Bajas (Experiencias 1-3): Cuando [I–] y persulfato [S2O82-] tienen concentraciones más bajas, los valores de ( k ) aumentan, lo que indica una mayor velocidad de reacción. Esto es común en reacciones en las que la concentración tiene un impacto significativo en la velocidad. Concentraciones altas (Experiencias 4-6): Cuando aumentamos las concentraciones de los reactivos, observamos una disminución en la constante de velocidad (k), lo que indica que la reacción puede estar acercándose a un estado de saturación o que otros factores, como la inhibición por producto, pueden estar reduciendo la velocidad de la reacción.
La alta concentración de persulfato (Experiencias 7-9): cuando hay una alta concentración de [S2O82-] y una baja concentración de [I–], los valores de ( k ) disminuyen aún más.
Conclusiones
Analizando los datos obtenidos gracias a la experimentación en los 3 casos trabajados a
diferentes concentraciones se pudo calcular el orden de reacción, la velocidad de reacción y la constante de velocidad de forma experimental. Los cálculos se realizaron de forma exitosa y se obtuvieron los resultados esperados de esta práctica. En las tablas podemos observar cómo afecta la concentración de los compuestos a la velocidad de reacción, lo cual nos ayuda a comprender la importancia del estudio de las reacciones. Vemos como en los casos 2 y 3 la velocidad calculada es parecida entre sí lo cual concuerda con los datos de tiempo obtenidos en la práctica en el laboratorio.
En definitiva, los órdenes parciales de reacción son indicativos de cómo la concentración de cada reactivo afecta la velocidad de la reacción. En relación con la estequiometría de la reacción, los órdenes parciales pueden proporcionar información sobre cómo están relacionadas las concentraciones de los reactivos con la velocidad de la reacción. Si los órdenes parciales son consistentes con la estequiometría de la reacción, podría sugerir que la reacción transcurre en una sola etapa. Sin embargo, se necesitaría más evidencia experimental para confirmar esto, como la determinación de la ecuación de velocidad y la realización de experimentos adicionales para verificar su validez.
Referencias
- Garrone, E.; Ugliengo, P. En Structure and Reactivity of Surfaces, Proceedings of the
European Conference, Trieste, Italy, Sept 13-20, 1988; Zecchina, A., Cost, G., Morterra, C., Eds.; Elsevier: Amsterdam, 1988 - Klingler, J. Influence of Pretreatment on Sodium Powder. Chem. Mater. 2005, 17, 2755-2768.
- Atkins, P. W., & de Paula, J. (2010). Physical chemistry (9th ed.). Oxford University Press.
- Laidler, K. J. (1987). Chemical kinetics (3rd ed.). Harper & Row.






Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.