Mateo Gavilanes1 & Alexia Rosero1
Escuela de Ciencias Químicas e Ingeniería, Laboratorio de Química, Yachay Tech University, 100119 Urcuquí, Ecuador
2023

Esta obra está bajo una Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
Tabla de Contenidos
Resumen
El enlace químico permite describir y analizar la estructura de la materia en sus diferentes estados de agregación: sólido, líquido y gaseoso. Es por ello, que la práctica consta de siete experiencias con el propósito de determinar las propiedades fisicoquímicas como cristalinidad, solubilidad, punto de fusión y ebullición, tensiones superficiales en compuestos iónicos y covalentes.
Estas sustancias son C2H3N6O2 (Acetato de Sodio), C8H8O3 (Vainillina), C6H10O5 (Almidón), NaCl (Cloruro de Sodio), C7H6O3 (Ácido Salicílico), C12H22O11 (Sacarosa) y NaF (Fluoruro de Sodio) y fueron analizadas por medio de equipos de laboratorio tales como: fusiómetro, estereoscopio y cabina extractora de gases, dando como resultado la formación de cristales, la conductibilidad y solubilidad de cada compuesto y formación de NaCl.
Palabras clave: tensión superficial; fuerzas intermoleculares; solubilidad.
Introducción
Gran parte del estudio de la Química implica la observación de cómo los átomos se combinan entre sí para formar compuestos. Para explicar esto, existe el concepto de enlace químico y sus tipos fundamentales: iónico y covalente. Los enlaces iónicos se forman entre un átomo metálico y uno no metálico, produciéndose una transferencia de electrones y una diferencia de carga. Por otra parte, los enlaces covalentes se dan entre dos o más átomos no metálicos que comparten sus electrones.
Ahora, las sustancias tienen sus propiedades que dependen de la fuerza de atracción entre sus partículas. Las fuerzas intermoleculares son atracciones electrostáticas que surgen de las interacciones carga-carga entre moléculas, estas dictan las propiedades físicas de las sustancias como su punto de fusión, punto de ebullición y densidad. Por otro lado, las fuerzas intramoleculares existen dentro de las moléculas y mantienen unidos sus átomos. Estas fuerzas mantienen intacta una molécula, es decir, un cambio en el estado de una sustancia no afecta las interacciones intramoleculares. Por ello, las fuerzas intermoleculares son más débiles que las intramoleculares.
Sin embargo, no hay sustancia 100% iónica o 100% covalente. Aquí interviene el concepto de reglas de Fajans utilizadas para predecir y explicar ciertos aspectos de la formación de compuestos iónicos y covalentes. De acuerdo a estas reglas, la polarización aumenta si
- aumenta la carga del catión o del anión
- cuando disminuye el tamaño del catión y aumenta el del anión
- si el catión tiene una configuración electrónica distinta a la de gas inerte o capa cerrada.
Méndez, E. (2011) menciona que cuando el enlace entre los iones que integran la red se torna predominantemente covalente aparecen desviaciones entre la energía de red calculada y la hallada experimentalmente. Es lo que ocurre por ejemplo en redes integradas por haluros y iones Ti4+ o Al3+.
En estos casos el enlace pierde gran parte de su carácter iónico, y los iones que conforman el cristal ya no pueden ser considerados como elementos rígidos. Comportamientos de este tipo pueden predecirse utilizando las reglas de Fajans que permiten pronosticar la existencia de una polarización de los iones de la red, o sea, de una deformación de los mismos y el desplazamiento de la nube electrónica desde el anión hacia el catión.
Materiales y Métodos
Aquí se introduce los reactivos y metodologías utilizadas en la práctica y se divide en 7 actividades:
Actividad 1. Observación de diferentes compuestos Iónicos o Covalentes a través de un estereoscopio.
En esta parte de la práctica se debe usar Cloruro de Sodio (NaCl), Sacarosa (C12H22O11), Almidón (C6H10O5), Ácido Salicílico (C7H6O3), Acetato de Sodio (C2H3NaO2), Espátulas, Vidrios de reloj, Estereoscopio.
Coloque la sustancia a trabajar minuciosamente en el vidrio reloj para que pueda identificar la forma de los cristales utilizando un estereoscopio. A continuación, la figura 1 representa el procedimiento.

Actividad 2. Determinación de puntos de fusión
En esta actividad para la determinación de los puntos de fusión se debe utilizar Cloruro de Sodio (NaCl), Sacarosa (C12H22O11), Almidón (C6H10O5), Ácido Salicílico (C7H6O3), Acetato de Sodio (C2H3NaO2), Espátulas, Fusiómetro y Capilares para un Fusiómetro.
Basándose en el mismo análisis anterior, se debe seleccionar una sustancia para analizar su punto de fusión en un capilar con aproximadamente 3 o 4 mm de muestra para colocar en el fusiómetro y observar con el lente. Es importante ser muy cuidadoso para evitar quemar la muestra y leer los datos de manera precisa. (Figura 2)
Actividad 3. Clasificación de muestras problemas A y B en Iónica y Covalentes dependiendo de sus propiedades
Se requiere del uso de Espátulas, Vidrios de reloj, Estereoscopio, Fusiómetro, Capilares para Fusiómetro, Muestras Problema A y B.
Cada muestra debe observarse en el estereoscopio para posteriormente medir sus puntos de fusión con un fusiómetro y así determinar si la muestra tiene carácter iónico o covalente. Véase Figura 3.

Actividad 4. Solubilidad de compuestos sólidos y covalentes
Se necesita usar agua destilada, 4 tubos de ensayo, 1 gradilla, Cloruro de Níquel (NiCl2), Cloruro de Sodio (NaCl), Fluoruro de Sodio (NaF), Cloruro de Magnesio (MgCl2), Naftaleno(C10H8), Etanol (C2H6O), N-Hexano (C6H14) y Acetona (C3H6O)
Agregar a cada uno de los tubos de ensayo 4 mililitros de agua destilada, etanol, n-hexano y acetona. Asegúrese de agregar un solvente a cada tubo de ensayo y sacudir la mezcla para así determinar las fuerzas intermoleculares y la solubilidad de esta sustancia. Representación en la Figura 4.

Actividad 5. Conductividad en diferentes soluciones
Se debe contar con un Circuito eléctrico, Agitador de vidrio, Agua destilada, Disolución de Cloruro de Sodio 1%, Disolución de Sacarosa 1%, Disolución de Acetato de Sodio 1%, Vinagre, Jugo de limón, Agua embotellada.
Colocar los extremos de los cables en diferentes soluciones puede ayudar a determinar si la solución conduce electrolitos de manera fuerte, débil o ninguna de las dos. (Figura 5)
Actividad 6. Tensión superficial y carrera de barcos
Aquí se usan diferentes tipos de detergente líquido (Manos, Lavavajilla, Cabello, Cuerpo y ropa), un recipiente grande lleno de agua, barquitos de plástico y una regla.
La competencia de barcos consiste en que cada equipo ponga su barco en la línea de salida, elija un tipo de detergente y llene la punta de un isopo de detergente para posteriormente acercar la punta al recipiente con agua. Después de la reacción, se debe medir la distancia recorrida por cada barco. Para mejor comprensión véase Figura 6.

Actividad 7. Preparación de Cloruro de Sodio de manera explosiva.
Para la formación de Cloruro de sodio se necesita jeringas de 20 ml, válvulas pasa suero, Cloro gas*, NaOCl (5 mL), Agua destilada, HCl 2M (5 mL), NaOH 1M (200 mL), Sodio metálico, Tubo de ensayo con tapón tipo septum y una Pinza de madera para tubo de ensayo.
Se debe configurar el sistema de producción de cloro gaseoso y tomar 5 mililitros de NaOCl en una jeringa para conectarla al sistema. Luego, coloque un pedazo pequeño de sodio solido inmediatamente.
Inyectar más cloro gaseoso y luego encender con una mecha da como resultado Cloruro de sodio.
Resultados y Discusión
Sección I. Análisis de la estructura, punto de fusión y conductividad de los compuestos iónicos y covalentes
Las Tablas 1 y 2 muestran características específicas de compuestos iónicos y covalentes. Antes de cada experimento, se analizó cada uno de los compuestos estudiados y se descubrió que el cloruro de sodio y el acetato de sodio son compuestos iónicos como resultado de la interacción entre un metal y un no metal; además, el sodio es el metal con una diferencia de electronegatividad superior a 1.6 como compuesto iónico.
Al realizar varias pruebas para evaluar sus propiedades físicas, se encontró el acetato se fundió en una temperatura de 334° C cuando fue expuesto al calor de 400 grados; sin embargo, el cloruro de sodio no cambió de estado a pesar de ser expuesto a 400° dado que su punto de fusión teórico es 801 grados. Estas variaciones son causadas por diferencias estructurales y fuerzas intermoleculares entre los componentes.
Por un lado, el cloruro de sodio tiene un enlace iónico puro, que tiene un fuerte enlace debido a la transferencia electrónica de iones, mientras que el acetato de sodio tiene un enlace ion-dipolo, que se rompe debido a la separación de cargas parciales. Esto se debe a que la nube electrónica creada por la molécula de acetato tiene una mayor carga electronegativa, lo que dificulta la separación de los enlaces.
Los compuestos covalentes identificados fueron la sacarosa, el almidón y el ácido salicílico; al observarlos en el estereoscopio, se descubrió que no todos eran amorfos porque la sacarosa tenía una estructura cristalina. Como resultado, se afirma que no todos los compuestos covalentes que se ven son amorfos. Según Burgos E. (1982) un cristal molecular es un arreglo periódico de moléculas las cuales conservan sus propiedades estructurales y dinámicas de la fase gaseosa (molécula libre).1 con esta afirmación: Las fuerzas intermoleculares entre las moléculas de cada compuesto favorecen o impiden la organización ordenada de enlaces, dependiendo del nivel de interacción que aporten. Las condiciones de formación cristalizan o amorfizan los compuestos, afectando el orden de organización a nivel estructural.
| Compuesto (Fórmula) | Tipo de compuesto | Cristalinidad | Forma del cristal | Punto de fusión experimental | Punto de fusión teórico(°C) | %Ea |
| Cloruro de Sodio (NaCl) | Iónico | Si | Cúbica | N/A | 801° | – |
| Fluoruro de Sodio (NaF) | Iónico | Si | – | – | – | – |
| Acetato de Sodio | Iónico | Si | Monoclinica | 334° | 324° | 1,6 |
| Sacarosa | Covalente | Si | Hexagonal | 218° | 180° | 0,5 |
| Almidón | Covalente | No | Amorfa | N/A | 60-80° | 9,4 |
| Vainillina | Covalente | Si | – | – | – | – |
| Ácido Salicílico | Covalente | Si | Triclinica | 185° | 159° | 0,6 |
| Compuesto (Fórmula) | Conductividad | Tipo de electrolito |
| Jugo de Limón | SI | Débil |
| Vinagre | Si | Débil |
| C2H3NaO2 al 1% | Si | Fuerte |
| C12H22O11 | No | – |
| NaCl al 1% | Si | Fuerte |
| H2O | No | – |
Para el estudio de la conductividad, se descubrió que el vinagre y todos los compuestos iónicos si condujeron electricidad y permitieron que se encienda la luz led. Esto se debe a que los compuestos con fuerzas intermoleculares de puente de hidrógeno se disocian en una solución y liberan cationes y aniones, ya sea fuertes o débiles, que actúan como portadores de cargas positivas y negativas.
En el jugo de limón, se demostró que hay paso de electrolitos porque el ácido nítrico se disocia con el agua y libera iones de hidrogeno cargados positivamente, lo que facilita la atracción débil de energía por el ánodo y el paso de energía. Para las muestras A y B se obtuvieron los siguientes datos (Tabla 3):
| Muestra | Cristalinidad | Tipo de cristal | Punto de Fusión |
| A | Si | Monoclínica | 115°-180° C |
| B | No | Amorfo | – |
De acuerdo con la tabla anterior y comparando con los datos de la tabla 1 se pudo determinar que la muestra A corresponde al compuesto Acetato de sodio y la muestra B al compuesto NaCl.
La experiencia demostró que cada una de las dos muestras presentadas contenía un compuesto que no se repetía debido a variaciones en sus propiedades físicas, lo que indica que tienen fuerzas intermoleculares diferentes. Después de examinar las muestras en el estereoscoscopio y someterlas al calor, se descubrieron sus puntos de fusión y sus propiedades ante los compuestos que se habían analizado previamente. Mostrando puntos de fusión diferentes entre cada compuesto.
Sección II. Análisis de la solubilidad de los compuestos iónicos y covalentes
Diferentes compuestos fueron analizados para conocer su solubilidad en diferentes solventes: agua, etanol, acetona y n-hexano (Tabla 4).
| Compuesto (Fórmula) | Solubilidad | ||||||
| Agua | Etanol | Acetona | N-hexano | ||||
| NaCl | Si | Poco Soluble | No | No | |||
| NaF | Si | Poco Soluble | No | No | |||
| MgCl2 | Si | Poco Soluble | No | No | |||
| NiCl2 | Si | Si | No | No | |||
| C10H8 | No | No | Si | Poco Soluble | |||
La polarizabilidad de una molécula está relacionada con su capacidad para formar fuerzas intermoleculares temporales o inducidas, lo que incluye en su capacidad para disolver ciertos compuestos. Cuanto más polarizable es una molécula, más fuertes son las fuerzas intermoleculares que puede experimentar, y, por lo tanto, mayor es su capacidad para interactuar con otros compuestos en una solución3.
El orden de poder polarizarte de los solventes mencionados, de mayor a menor, es:
Agua > Acetona > Etanol > N-hexano
Por lo tanto, la solubilidad de los compuestos iónicos se debe a las fuerzas electrostáticas entre los iones del compuesto y las moléculas del solvente polar (como el agua y el etanol).
Mientras que la solubilidad de los compuestos covalentes se debe a las fuerzas de atracción entre moléculas covalentes similares (como las fuerzas de Van der Waals) y la polaridad del solvente.
En cuanto a las reglas de Fajans, estas se utilizan principalmente para predecir la polarizabilidad de los iones en un compuesto iónico, pero en este caso, no parecen aplicarse directamente a la solubilidad de los compuestos. Sin embargo, es importante mencionar que las fuerzas de polarización también juegan un papel en las fuerzas intermoleculares y, por lo tanto, en la solubilidad de los compuestos.
En la Tabla 5 se presentan los líquidos empleados para el experimento, así como sus valores de tensión superficial.
| Líquido | Distancia recorrida | Tensión superficial (dyn/cm) |
| Detergente de Cabello | 32 | 0.078125 |
| Detergente de Manos | 34 | 0.078125 |
| Detergente de Ropa | 34 | 0.078125 |
| Detergente de Cuerpo | 33 | 0.078125 |
| Detergente de Lavavajillas | 39 | 0.078125 |
| Agua | – | 1 |
FORMACIÓN DE CLORURO DE SODIO (NaCl)
En esta experiencia primero se realizó la formación de cloro gaseoso mediante la reacción entre hipoclorito de sodio (NaOCl) y ácido clorhídrico (HCl).
Formación de cloro gas con hipoclorito de sodio más HCl 6 M. Ecuación (1):
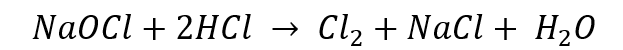
Una vez formado el cloro gaseoso, se inyectó en un tubo de ensayo que contenía sodio metálico. En esta etapa, se pudo observar que ocurrió una reacción explosiva, liberando una gran cantidad de energía. Después de esto, se añadió una gota de agua y se observó la formación inmediata de cloruro de sodio (NaCl) y liberación de hidrógeno gaseoso (H2), de acuerdo con la ecuación (2):
Formación del cloruro de sodio:

Dado que se utilizó 5ml de NaOCl y 5 ml de HCl, se puede calcular los moles de cada reactivo utilizando las concentraciones:
- Moles de NaOCl:

- Moles de HCl:

Para determinar el reactivo limitante, se compara las cantidades de moles de NaOCl y HCl. En este caso, el NaOCl es el reactivo limitante, debido a que solo tenemos 0.005 moles de NaOCl y 0.01 moles de HCl.
Por lo tanto, la cantidad de cloro producido será igual a la cantidad de moles de NaOCl utilizado, que es 0.005 moles.
Para calcular la cantidad de cloro en condiciones estándar, se puede utilizar la ley de los gases ideales:
PV = nRT

Suponiendo que la temperatura estándar es 25°C = 298.15 K.
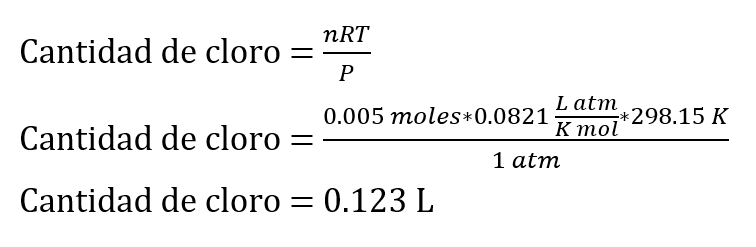

Conclusiones
Las fuerzas moleculares existentes se determinaron utilizando las propiedades producidas en los compuestos analizados en la práctica, así como las diferencias en los puntos de fusión entre los compuestos iónicos y covalentes, teniendo en cuenta su solubilidad y la forma de los cristales.
Además, se aplicaron las reglas de Fajans a cada uno de estos compuestos, lo que permitió predecir y comprender mejor el nivel de fusión y solubilidad de cada uno de los compuestos.
Referencias
- Méndez, E. Manual de físicoquímica I. 2011.
- Burgos, E.; Modelos de campo de fuerza en cristales moleculares. Comisión Nacional de Energía Atómica 2023.
- Chang, R.; Goldsby, K, A.: Química (11 edición); The McGraw-Hill: Mexico, 2013.






Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.