Cultivo de segmentos nodales de tallo de naranjilla (Solanum quitoense) en medio MS

La naranjilla (Solanum quitoense) es un frutal andino de alto valor económico, cuya propagación convencional presenta limitaciones. El cultivo in vitro de segmentos nodales en medio MS (Murashige y Skoog) surge como una alternativa eficiente para la multiplicación clonal de genotipos superiores. Este artículo titulado ¨ Cultivo de segmentos nodales de tallo de naranjilla (Solanum quitoense) en medio MS ¨ describe la metodología para establecer cultivos asépticos de segmentos nodales de tallo, analizando el efecto de reguladores de crecimiento en la brotación axilar y el desarrollo de plántulas.
Introducción
El cultivo in vitro de tejidos vegetales es una de las opciones tecnológicas modernas que posibilitan la propagación vegetativa de las plantas, de forma genérica, se incluye el cultivo de protoplastos, células, tejidos, órganos y plantas en general, teniendo en común condiciones de esterilidad en un medio de cultivo nutritivo, normalmente gelificado y en condiciones ambientales controladas, especialmente luz y temperatura (Estopá-Bagot, 2005). El cultivo in vitro, permite la propagación masiva de progenies sanas, genéticamente uniformes, posibilita la recuperación de caracteres morfológicos juveniles rompiendo las relaciones entre el explante y el conjunto de la planta (Ramírez & Salazar, 1997).
La propagación clonal o vegetativa de segmentos nodales, es decir, segmentos que se hacen de las porciones vegetativas de la planta como los tallos, tallos modificados, hojas e incluso raíces, se emplean tejidos vegetales que conserven su potencialidad de multiplicación y diferenciación celular para generar nuevos órganos (Gutierrez-Rosati, 2004).
En la actualidad, en Ecuador suscita una grave incidencia de punta morada (PM) en diversos cultivos de solanáceas en gran parte del territorio, se ha detectado en papa (Solanum tuberosum), tomate de árbol (Solanum betaceum), uvilla (Physalis peruviana) y naranjilla (Solanum quitoense) (Viera et al., 2021). Esta enfermedad conjuntamente con otras, no solo asociadas a fitoplasmas, si no también otros hongos y bacterias son de importancia económica por lo que explorar métodos de control y propagación de plantas resulta vital para no perder la superficie cultivada de estos rubros agrícolas.
En Ecuador, la naranjilla es uno de esos rubros importantes en la economía nacional, siendo la región Amazónica la que acapara más del 93 % de la superficie cultivada del país y un 7 % distribuido entre las estribaciones de los Andes, alcanzando unas 5.49 t/ha (Silva et al., 2016).
Este informe de laboratorio describe los resultados del cultivo in vitro de segmentos nodales de naranjilla en cultivo MS, sin la adición de estimulantes, a fin de comprender los procesos fisiológicos que el explanto experimenta hasta convertirse nuevamente en una plántula lista para ser habituada in vivo y de esta manera fundamentar la importancia de la micropropagación vegetal en condiciones de laboratorio.

Objetivos
- Cultivar en medio MS, dos segmentos nodales de plántulas de naranjilla previamente cultivadas in vitro en el Laboratorio de Biotecnología Vegetal de la Facultad de Ciencias Agrícolas – UCE.
- Discutir a la luz de la literatura los procesos fisiológicos asociados al cultivo de segmentos nodales in vitro.
- Obtener un cultivo de segmentos nodales de naranjilla libre de patógenos (axénico) para posteriormente habituarlos in vivo.
Materiales y métodos
Materiales y reactivos
- 1 frasco de vidrio con medio MS previamente esterilizado y herméticamente sellado
- Material vegetal: plántulas de naranjilla sanas, cultivadas in vitro con suficientes segmentos nodales de tallo
- Pinzas
- Bisturí
- Alcohol al 96 %
- Mechero
- Incubadora
- Cámara de flujo laminar
- Servilletas esterilizadas
- Rotulador
- Papel aluminio
- Parafilm
Metodología
Sitio Experimental: Laboratorio de Biotecnología Vegetal de la Facultad de Ciencias Agrícolas, Universidad Central del Ecuador.
Procedimiento:
- Esterilizar el área de trabajo dentro de la cámara de flujo laminar, la cámara debe estar encendida.
- Retirar el parafilm y flamear el frasco con el cultivo in vitro de naranjilla de donde se obtendrán los segmentos nodales.
- Con las pinzas previamente flameadas, retirar la tapa de aluminio del cultivo de naranjilla del cual se obtendrán los segmentos nodales.
- Repetir la operación (2-3) con el frasco con medio MS donde se sembrarán los segmentos nodales.
- Rociar alcohol en el paquete de servilletas.
- Con un bisturí previamente flameado, abrir un paquete de servilletas esterilizadas y colocarlas en la superficie de la mesa de trabajo de la cámara de flujo laminar.
- Con el bisturí y las pinzas previamente flameadas cortar uno o dos tallos de naranjilla cultivada in vitro y colocarlos sobre la servilleta.
- Con el bisturí esterilizado, hacer incisiones de modo que se obtengan 2 segmentos nodales de tallo de aproximadamente 1 a 1.5 cm de largo con al menos una yema en buenas condiciones.
- Tomar un segmento con la pinza previamente esterilizada e inclinando casi horizontalmente el frasco de vidrio con medio MS, introducir en el medio el segmento de modo que no toque el fondo y la yema quede con la inclinación correcta, no tomar el segmento por la yema ya que podría dañarse, el segmento debe quedar vertical, repetir la operación con el segundo segmento con una distancia de 2 a 3 cm entre sí.
- Flamear el frasco y la tapa de aluminio, tapar y recubrir con rollopack.
- Rotular el frasco y llevar a la incubadora por alrededor de 20 días en oscuridad.
- Al cabo de 3 semanas aproximadamente sacar de la incubadora y colocar en las estanterías en la zona de habituación hasta que esté en condiciones de trasplantar a sustrato. El cultivo deberá estar libre de contaminación microbiana.
Resultados
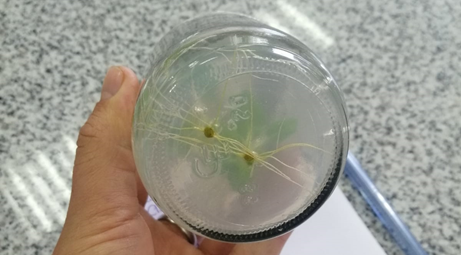
El cultivo de segmentos nodales se llevó a cabo el 4 de julio de 2022 (Fig. 1) y la observación de resultados se realizó el 25 de julio de 2022, es decir, desde el momento de la siembra hasta la observación de resultados, transcurrieron 21 días. Se observó que ambos segmentos se encontraban sanos y libres de patógenos como se identifica en la figura 2. Se observan raíces primarias y secundarias, y ambas plántulas con 3 hojas de color verde, vigorosas de unos 4 cm de alto aproximadamente.

Las raíces al cabo de 21 días son abundantes y empiezan a poblar toda la base del frasco, en algunos casos salen del medio y se observan raíces secundarias abundantes (Fig. 3).

Discusión
El cultivo in vitro de segmentos nodales (explante) de naranjilla (Solanum quitoense) es una técnica de micropropagación de organogénesis directa ya que no se genera un estadío de callo previo la obtención de yemas o brotes directos, plantas in vitro se propagan clonalmente por organogénesis directa para mejorar los rangos de multiplicación, así como para obtener plantas transgénicas (Cardoza, 2008). Sin embargo, el desarrollo exitoso de explantos de tallo depende de varios factores asociados especialmente al material vegetal del cual se originará el clon resultante y las condiciones de asepsia del procedimiento.
Los explantes de Solanum dolichosepalum, solanácea usada como patrón de naranjilla, pueden tener una respuesta diferente en función a la posición del tallo desarrollado in vitro, esta variación puede deberse a la cercanía con el meristemo apical, sitio de síntesis del ácido indol acético (AIA), es decir, entre más lejos se encuentre la yema de la zona apical, la respuesta del segmento nodal a la organogénesis de microtallos se reduce (Cárdenas-Burgos et al., 2016).
Por otro lado, la edad fisiológica del material vegetal empleado para la propagación in vitro es importante, por ejemplo, en segmentos nodales de guanábana (Anonna muricata) originados de plantas adultas presentan cambios progresivos como la perdida de la capacidad morfogenética, totipotencialidad y niveles adecuados de hormonas, además in vitro el tejido vegetal de la planta adulta tiende a permanecer latente, a desarrollar callo y morir por lo que se considera óptimo propagar explantes de plantas relativamente jóvenes (García-Águila et al., 2012), esto es consistente con la metodología planteada en este ensayo experimental ya que se emplearon plántulas de naranjilla de las cuales se obtuvieron los segmentos nodales con los que se alcanzó organogénesis directa con éxito.
Otro factor a tomar en cuenta para un desarrollo óptimo de los explantos es la incidencia de compuestos fenólicos, especialmente en especies leñosas, estos compuestos son responsables de la muerte celular en explantes; cuando se extrae un explante de la planta madre, la primera respuesta del tejido es la oxidación de compuestos fenólicos en el sitio de corte lo que puede conllevar a la muerte de los tejidos vegetales (Díaz et al., 2020).
Conclusiones
La organogénesis directa mediante el cultivo de segmentos nodales de tallo de naranjilla (Solanum quitoense) es viable en el medio MS sin la adición de fitohormonas durante un periodo de establecimiento de unos 20 días hasta que las plántulas se encuentren en condiciones de realizar fotosíntesis y ser completamente autótrofa.
Para evitar la contaminación del medio de cultivo con microorganismos es importante seguir los protocolos de esterilización dentro de la cámara de flujo laminar, pero adicionalmente se pueden adoptar medidas complementarias como la inmersión de los segmentos nodales en soluciones diluidas de hipoclorito de sodio al 2 %.
Factores fisiológicos como la proximidad de las yemas con la zona meristemática apical, por la síntesis de AIA, la edad del material vegetal de origen y la oxidación de compuestos fenólicos, son determinantes en el éxito del cultivo de segmentos nodales, además de un manejo o manipulación adecuada del material vegetal ya que los daños mecánicos, especialmente en las yemas, puede restringir el éxito de los brotes de la parte aérea de la plántula.
Recomendaciones
Aunque en este ensayo no se evidenció contaminación microbiana, es recomendable que en la fase de establecimiento in vitro se trate a los explantos con una solución de hipoclorito de sodio al 2 % por 15 minutos como lo sugieren los investigadores López et al. (2016).
En este estudio experimental no se emplearon hormonas, enzimas o bioestimulantes, sin embargo y a fin de acortar el tiempo de espera para el desarrollo de segmentos nodales, se puede sugerir emplear auxinas, las poliaminas, los brasinoesteroides y las estrigolactonas como fitohormonas con potencial enraizante ya que pueden inducir de manera específica la proliferación del tejido del sistema radicular aumentando la longitud de raíces adventicias y primarias (Alcántara et al., 2021).
Referencias
Alcántara, J., Acero, J., & Sánchez, R. (2021). Metabolitos con potencial fitohormonal en el cultivo de especies vegetales: aplicaciones en biotecnología. Enviroment & Technology, 2(1), 18–47. https://revistaet.environmenttechnologyfoundation.org/index.php/envitech/article/view/34/26
Cárdenas-Burgos, C., Pacheco-Maldonado, J., & Valenzuela, A. (2016). Propagación un vitro de Solanum dolichosepalum (Solanaceae). Ciencia En Desarrollo, 7(2), 9–22.
Cardoza, V. (2008). Tissue Culture: The Manipulation of Plant Development. In C. Neal & J. Stewart (Eds.), Plant Biotechnology and Genetics: Principles, Techniques, and Applications (pp. 113–134). John Wiley & Sons, Inc.
Díaz, M., Rodas, J., González, L., & Vera de Ortiz, M. (2020). Establecimiento in vitro de segmentos nodales de Handroanthus heptaphyllus de flores blancas. Biotecnología Vegetal, 20(3), 203–210.
Estopá-Bagot, M. (2005). El cultivo in vitro en la reproducción vegetativa en plantas de vivero. Revista Extra, 50–56. http://www.horticom.com/Revistasonline/extras/2005/M_Estopa.pdf
García-Águila, L., Álvarez, J., Alvarado-Capó, Y., González, M., la O, M., Mirabal, D., & Romero, C. (2012). Establecimiento in vitro de segmentos nodales de plantas jóvenes de Annona muricata L. Biotecnología Vegetal, 12(4). https://revista.ibp.co.cu/index.php/BV/article/view/179
Gutierrez-Rosati, A. (2004). Información Biomorfológica de la “Chia” Salvia hispanica L. https://hortintl.cals.ncsu.edu/sites/default/files/articles/caracteristicas_biomorfologicas_Chia.pdf
López, M., Solórzano, F., Pomagualli, D., López, T., & Vergara, G. (2016). Propagación in vitro del sauce llorón (Salix babilonica Lin.) a partir de segmentos nodales. Revista de Investigación Talentos, 3(2), 22–29. https://talentos.ueb.edu.ec/index.php/talentos/article/view/59/92
Ramírez, M., & Salazar, E. (1997). Establecimiento in vitro de segmentos nodales de guayabo (Psidium guajava L.). Revista de La Facultad de Agronomía Universidad Del Zulia, 14, 497–506. https://www.revfacagronluz.org.ve/v14_5/v145z003.html
Silva, W., Gómez, P., Viera, W., Sotomayor, A., Viteri, P., & Ron, L. (2016). Selección de líneas promisorias de naranjilla para mejorar la calidad de la fruta. Ecuador Es Calidad: Revista Científica Ecuatoriana, 3(1). https://doi.org/10.36331/revista.v3i1.21
Viera, W., Viteri, P., Martínez, A., Castillo, C., & Peñaherrera, D. (2021). Guía para el conocimiento de la punta morada en tomate de árbol (Solanum betaceum Cav.) y alternativas para un manejo integrado. Boletín Divulgativo No 449. https://repositorio.iniap.gob.ec/bitstream/41000/5762/1/Gu%C3%ADa%20de%20punta%20morada%20de%20tom%C3%A1te%20de%20%C3%A1rbol.pdf
Sugerencia
¿Te gustaría conocer más sobre cómo impulsamos la innovación y el conocimiento desde Eñengi? Visita nuestra página y descubre cómo estamos transformando el futuro a través del e-learning. ¡Haz clic aquí y únete a nuestra comunidad de cambio!

One comment
Leave a Reply
You must be logged in to post a comment.







[…] de plantas ornamentales como las orquídeas endémicas de la selva, la restauración de bosques, la generación de plantas modificadas para producir nutrientes esenciales, o la producción de fármacos, entre otros (Perea, 2009; UTEC, […]