Alejandro Aguirre, Nicol Diguay, Marco Gutierres, Santiago Loor, Jimmy Pilco y Vanessa Vizuete.
Febrero de 2023
Tabla de Contenidos
Introducción
La agricultura es una actividad esencial para la producción de alimentos y fibras. Sin embargo, la agricultura tradicional, basada en el uso intensivo de insumos químicos, tiene un impacto negativo en el medio ambiente (García & Flego, 2008). Los insumos químicos, como los fertilizantes, los pesticidas y los herbicidas, pueden contaminar el suelo, el agua y el aire. Además, pueden tener un impacto negativo en la salud humana y animal.
En este contexto, los insumos agrícolas tradicionales han sido objeto de escrutinio debido a sus impactos ambientales y su contribución a la degradación del suelo y la calidad del agua. En respuesta a este llamado a la sostenibilidad, emergen los bioinsumos como una propuesta prometedora para transformar la agricultura convencional. Viera et al., (2020) da una idea de que es los bioinsumos, insumos de carácter biológico, se originan como alternativas respetuosas con el medio ambiente que buscan mitigar los impactos negativos asociados con los métodos tradicionales de cultivo. De aquí parte la idea de los insumos agrícolas alternativos de carácter biológico son una alternativa sustentable puesto que estos se producen a partir de fuentes renovables, como los residuos orgánicos, las plantas y los microorganismos. Los insumos agrícolas alternativos de carácter biológico tienen el potencial de reducir el impacto ambiental de la agricultura (Aristizabal & Ramírez, 2023).
Este cambio hacia los bioinsumos refleja una conciencia creciente de la interconexión entre la salud del suelo, la biodiversidad y la producción alimentaria sostenible. En este sentido, este artículo se adentra en la exploración detallada de los bioinsumos como una respuesta innovadora y eficaz a los desafíos actuales en la agricultura. Se busca identificar los diferentes tipos de bioinsumos y cómo pueden adaptarse a los múltiples contextos en la agricultura.
Definición de insumo de origen biológico
Los bioinsumos pueden ser clasificados desde distintos puntos de vista. Así por ejemplo en cuanto a su origen, pueden ser bioinsumos de origen vegetal o microbianos; y en cuando a su efecto sobre la planta, pueden ser clasificados en dos grandes grupos: biofertilizantes y biopesticidas. Asimismo, en estas categorías se pueden identificar subcategorías, como, por ejemplo, dentro de los biofertilizantes se distinguen los bioestimulantes del crecimiento, inoculantes microbianos, bioestabilizadores, incluyendo también en este grupo a los abonos orgánicos, humus y guano. Dentro de los biopesticidas se distinguen los microbiocidas, los bioinductores de la defensa vegetal contra plagas y enfermedades y los biorepelentes (Mamani de Marchese & Filippone, 2018).
Tipos de bioinsumos
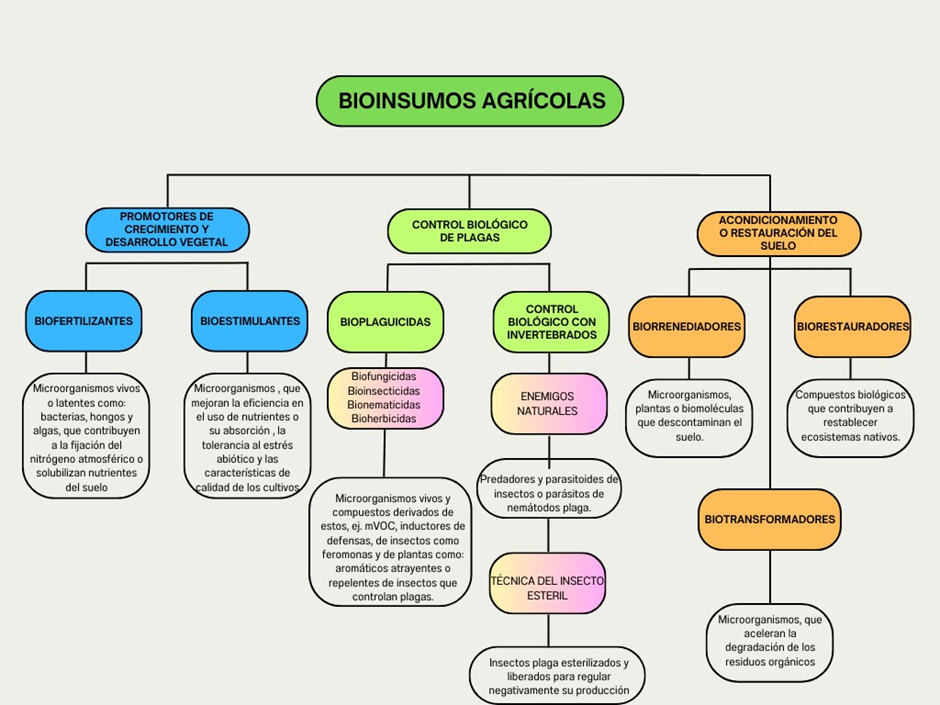
Fuente: Tomado y modificado de Bullur et al. (2023) y FAO (2023).
Fertilizantes biológicos
Los biofertilizantes o inoculantes microbianos se caracterizan por ser sustancias que tienen organismos microbianos vivos o en estado de latencia, es un producto capaz de mejorar la productividad (o rendimiento), calidad y/o sanidad al aplicarlos sobre cultivos vegetales, sin generar impactos negativos en el agroecosistema (Mamani de Marchese & Filippone, 2018).
En estos biofertilizantes se utilizan microorganismos benéficos como hongos micorrícicos arbusculares y rizobacterias que promueven el crecimiento vegetal ya que viven en simbiosis con las plantas y ayudan en la nutrición y regeneración del suelo (Mamani de Marchese & Filippone, 2018). Por ejemplo: Azospirillum y Azotobacter como fijadores de N; Pseudomonas y Bacillus como controladores de hongos fitopatógenos como Fusarium, Rhizoctonia, Pythium, Colletotrichum, Verticillium y Botrytis; y hongos del género Trichoderma (Chauca & Oñate, 2023). De esta manera, en una investigación sobre el uso de especies de Trichoderma en arroz se determina que principalmente T. harzianum puede aplicarse solo o junto con otros microorganismos para promover significativamente el crecimiento y el rendimiento, seguido de T. asperellum, T. viride, T. virens y T. atroviride. Por lo tanto, los hallazgos demostraron el potencial de las especies de Trichoderma como un posible biofertilizante y control biológico para el cultivo de arroz en todo el mundo (Debnath et al., 2020). Adicional, en una investigación en el CADET en fréjol arbustivo se usó como biofertilizante 2 dosis de Bacillus subtilis (D2 250 ml y D3 500 ml)y un testigo (D1 sin aplicación), donde el mejor resultado obtuvo la interacción de la dosificación de 500 ml y la variedad Centenario con mayor concentración de P (351,97 ppm) y un rendimiento de 3.763,89 kg ha-1, la misma que refleja ser económicamente rentable con una ganancia neta de $ 0,32 por dólar invertido (Chávez & Vásquez, 2021).
Tendencia en la aplicación de microorganismos eficientes en la gestión de la fertilidad del suelo
El suelo es considerado como uno de los hábitats más diversos y complejos en el que habitan aproximadamente 109 células bacterianas g-1 y 106 propágulos fúngicos g-1 (Dubey et al., 2019). Adicionalmente, este hábitat alberga organismos del dominio Archaea, cianobacterias, protozoarios, virus y macroorganismos (Ferrera-Cerrato, 2007; Zheng et al., 2019). Siendo el suelo un hábitat altamente dinámico, la estructura de su microbiota depende de las condiciones climáticas de la localización geográfica y de las características fisicoquímicas del suelo, incluyendo pH, concentración de carbono orgánico, salinidad, textura y concentración de nitrógeno disponible (Tian et al., 2017). Por ejemplo, el pH, la concentración de carbono orgánico o de nitrógeno total hacen que exista mayor diversidad de bacterias en los suelos tropicales que en los del subtrópico (Li et al., 2019). Asimismo, el modo de labranza influye significativamente en la conformación de las comunidades microbianas del suelo (Köberl et al., 2020). Adicionalmente, en términos de diversidad microbiana, los cambios en los factores mencionados conducen a una elevada variabilidad a nivel de especies. Sin embargo, nueve filos bacterianos; Bacteroidetes, Chloroflexi, Firmicutes, Gemmatimonadetes, Nitrospirae, Planctomycetes y Proteobacteria son considerados dominantes en el microbiota del suelo (Zhang et al., 2013).
En función de su elevada biomasa (> 1000 Kg carbono ha-1), diversidad y versatilidad metabólica, los microorganismos del suelo cumplen un papel crucial en el ciclo de los nutrientes (hierro, azufre, fosforo y nitrógeno) y la materia orgánica (Fierer, 2017). En conexión con esto, la fertilidad del suelo también se asocia con el metabolismo de los microorganismos que en él habitan. La producción de metabolitos microbianos como fitohormonas y sideróforos, que promueven el crecimiento vegetal y la secreción de exopolisacárido que incrementa la capacidad de retención de agua del suelo, son ejemplos de lo anterior (Backer et al., 2018).
BIO»REPELENTES«
Diferentes especies de bacterias del género Pseudomonas pueden favorecer activamente el crecimiento de las plantas aún en presencia de suelos infectados de hongos y bacterias patógenos responsables de enfermedades radiculares (Villa et al.,2005)
La presencia de estas bacterias en el suelo cumple con un doble propósito, promover el crecimiento vegetal al favorecer la presencia de organismos benéficos como las micorrizas, y suprimir la presencia de microorganismos patógenos gracias a la producción de metabolitos secundarios, y el efecto disuasivo que tienen para con plagas, al activar toxinas, y a través de la inducción de los mecanismos propios de defensa que poseen los vegetales a través de exudados radiculares inmunoprotectores (Pérez et al., 2005). Además, poseen una alta tasa de reproducción
Fijación biológica del nitrógeno
El nitrógeno es un elemento esencial para la vida de las entidades biológicas ya que es requerido para la síntesis de macromoléculas como proteínas y ADN; a pesar de su abundancia en la atmósfera, en la forma de dinitrógeno gaseoso, únicamente limitadas reservas de nitrógeno inorgánico (nitrato y amonio), se encuentran disponibles en el suelo para el desarrollo vegetal (Pankievicz et al., 2019). La deficiencia de este factor limitante en los agroecosistemas usualmente se suple mediante la adición de fertilizantes nitrogenados sintéticos (Mahmud et al., 2020). Sin embargo, la producción industrial de éstos demanda un elevado consumo de energía y, consecuentemente, un alto costo económico (Cherkasov et al., 2015). Además, la emisión de óxido nitroso hacia la atmósfera y la eutrofización de cuerpos de agua subterránea y superficial, debido a la fuga de nitrógeno reactivo desde el suelo, son ejemplos de la afectación ecológica que resulta de la aplicación de este tipo de fertilizantes (Zhang et al., 2020).
En la naturaleza, determinados microorganismos del suelo cumplen un rol importante en el ciclo del nitrógeno. Las transformaciones microbianas del nitrógeno son representadas por seis pasos que incluyen la fijación de dinitrógeno gaseoso como amonio que posteriormente es asimilado y convertido en nitrógeno orgánico formando parte de la biomasa (Kuypers et al., 2018). Asimismo, la degradación de moléculas nitrogenadas orgánicas libera amonio que es oxidado a nitrato mediante un proceso de nitrificación (NH4+ → NO2– → NO3–) y eventualmente convertido en dinitrógeno gaseoso nuevamente mediante denitrificación (NO3– → NO2– → NO → N2O → N2) u oxidación anaeróbica del amonio (NH4+ + NO2– → N2 + 2H2O) (Kuypers et al., 2018).
Dentro de ese contexto, los microorganismos responsables de la Fijación Biológica del Nitrógeno (FBN) son conocidos como diazotróficos e incluyen especies de los dominios Bacteria y Archaea, además de limitados organismos eucariotas (Mahmud et al., 2020). Esta capacidad metabólica, que constituye una ventaja competitiva en el ecosistema, depende de la metaloenzima nitrogenasa (Peng et al., 2018). Este complejo enzimático se compone de la proteína catalítica dinitrogenasa y una ferroproteína donadora de electrones dependiente de ATP conocida como dinitrogenasa reductasa (Hoffman et al., 2014). El dominio catalítico de la dinitrogenasa, generalmente, contiene un cofactor Molibdeno-Hierro, pero en algunas especies el cofactor puede estar compuesto por Vanadio-Hierro o únicamente Hierro (Pankievicz et al., 2019). Los genes estructurales que codifican Mo-nitrogenasa y Fe-nitrogenasa se organizan en operones individuales nifHDK y anfHDGK, respectivamente, mientras que los genes que codifican la Va-nitrogenasa se organizan en dos operones, vnfHFd y vnfDGK, regulados independientemente (Lei et al., 2000). En ese contexto, la bacteria Azotobacter vinelandii codifica los tres tipos de nitrogenasas, mientras que otros microorganismos como los rizobios y los fijadores de nitrógeno marino del género Trichodesmium poseen únicamente Mo-nitrogenasa (Zehr et al., 2003). En función de la composición del complejo enzimático, la disponibilidad de vanadio, molibdeno o hierro en el suelo constituye un factor limitante dentro de la FBN (Darnajoux et al., 2019). Los componentes del complejo nitrogenasa son oxígeno lábil (Kuypers et al., 2018). Aunque microorganismos aerobios como Azotobacter vinelandii protege la nitrogenasa y su actividad al consumir el oxígeno mediante citocromo oxidasas, las condiciones de aerobiosis en el suelo también pueden limitar la FBN (Mahmud et al., 2020).
Los diazótrofos pueden clasificarse en tres grupos dependiendo del mecanismo involucrado en relación con las FBN (Kneip et al., 2007). Los diazótrofos simbióticos fijan nitrógeno únicamente en estructuras especializadas (nódulos) formados en hospedadores específicos de la familia Leguminosae, con excepción de Frankia spp. que puede deformar nódulos en árboles no pertenecientes a las leguminosas (Boyd & Peters, 2013). Asimismo, los diazótrofos endofíticos fijan nitrógeno al desarrollarse dentro de tejidos vegetales de leguminosas y no leguminosas, sin formar estructuras especializadas (Gupta et al., 2019). Finalmente, las bacterias diazotróficas asociativas y de vida libre pueden fijar nitrógeno mientras se desarrollan en la superficie de las raíces o en el suelo rizosférico (Nag et al., 2020).
Aproximadamente el 25 % del nitrógeno fijado anualmente en los sistemas agrícolas del planeta (33 a 46 millones de toneladas de N), corresponde a fijación simbiótica (Masson-Boivin et al., 2009). Este sistema de fijación se restringe, principalmente, a la relación de simbiósis entre leguminosas y bacterias conocidas como rizobios (Mus et al., 2016), este término generaliza a las bacterias de los filos α y β-proteobacteria que son capaces de formar nódulos de raíz en sus hospederos (Ferrera-Cerrato, 2007; Lindström & Mousavi, 2020; Shamseldin et al., 2017), este grupo de bacterias comprende 18 géneros de las familias Rhizobiacea (Rhizobium, Ensifer, Allorhizobium, Pararhizobium, Neorhizobium, Shinella), Phyllobacteriacea (Mesorhizobium, Aminobacter, Phylobacterium), Brucelaceae (Ochrobactrum), Methylobacteriaceae (Methylobacterium, Microvirga) Bradyrhizobiaceae (Bradyrhizobium), Xanthobacteraceae (Azorhizobium), Hyphomicrobiaceae (Devosia) y Burkholderiaceae (Paraburkholderia, Cupriavidus, Trinickia) (Dreyfus et al., 1988; Garrity, 2007; Jaiswal et al., 2021; Kuzmanović et al., 2020; Lindström & Mousavi, 2020; Mousavi et al., 2014; Rivas et al., 2003, 2004; Sy et al., 2001; Sylvia et al., 1999; Tao et al., 2004; Vandammel et al., 2002; Vaneechoutte et al., 2004; W. Wang & Zhu, 2012).
La taxonomía de estas bacterias está continuamente en un estado de cambio, en gran parte debido al rápido desarrollo de técnicas refinadas de biología molecular. El aislamiento y caracterización de bacterias nodulíferas de leguminosas nuevas, y a menudo diferentes, en una variedad de plantas hospedantes ha dado como resultado el nombramiento de muchas nuevas especies de rizobios. Aquí actualizamos la taxonomía de las bacterias nodulíferas de leguminosas y describimos rizobios recién identificados capaces de nodular leguminosas comestibles y árboles de leguminosas (Shamseldin et al., 2017). La principal fuente de referencia sobre taxonomía de rizobios es el Subcomité de Taxonomía de Rizobios y Agrobacterias del Comité Internacional de Sistemática de Procariotas (de Lajudie & Young, 2020a, 2020b; Young et al., 2001; Zakhia & Lajudie, 2006). Las bacterias que forman nódulos en diferentes géneros y especies de leguminosas son (Ferrera-Cerrato, 2007; Sylvia et al., 1999):
Rhizobium
R. leguminosarum; con tres biovars:
trifolii (Trifolium, tréboles)
viciae (Pisum, guisantes; Vicia, habas de campo; Lathyrus y Lens)
phaseoli (Phaseolus, frijol)
R. loti (Lotus, trébol)
R. tropici (Phaseolus, frijol; Leucaena, Ipil-Ipil, y Macroptilium)
R. etli (Phaseolus)
R. galegae (Galega, Leucaena)
R. huakuii (Astragalus)
R. ciceri (Cicer)
R. mediterraneum (Cicer)
Sinorhizobium
S. meliloti (Melilotus, trébol dulce; Medicago sativa, alfalfa; y Trigonella, alholva)
S. fredii (Glycine)
S. saheli (Sesbania)
S. teranga (Sesbania, acacia)
Bradyrhizobium
B. japonicum (Glycine, soya)
B. elkanii (Glycine)
B. liaoningense (Glycine)
Azorhizobium
A. caulinodans (Sesbania)
Actualmente las nuevas técnicas de identificación, caracterización taxonómica y secuenciación han permitido determinar un mapa filogenético mucho más amplio de simbiontes de raíz como lo recogen en su estudio Shamseldin y colaboradores (Shamseldin et al., 2017). Por otro lado, para el caso específico de México se han identificado nuevas especies de bacterias de los géneros Rhizobium y de Sinorhizobium (ahora llamado oficialmente Ensifer), así como, R. grahamii, R. mesoamericanum, R. endophyticum, S. mexicanum, S. chiapanecum y S. americanum,además de nuevos linajes de rizobios (Ramírez-Puebla et al., 2019). Para Ecuador (Bernal & Graham, 2001) se han publicado estudios realizados con distintas cepas: i) 69 cepas de Ecuador provenientes de la colección mantenida en el laboratorio de Rhizobiología del Departamento de Suelos de la Universidad de Minnesota (www. Rhizobium.umn.edu), ii) cepas del Perú (11), Kenya (1), y Argentina (9), incluyendo cepas de Phaseolus aborigeneus (cortesía del Dr. Daniel Debouck, Centro Internacional de Agricultura Tropical (CIAT), y iii) ocho aislamientos de México (cortesía de la Dra. Valeria Souza, Universidad Autónoma de México, Cuernavaca).
La asociación entre las bacterias nodulantes y la planta hospedadora depende del intercambio de carbono, provisto mediante fotosintatos de la planta como fuente de energía para el microorganismo, y de nitrógeno, en forma de amonio, que es retornado a la planta mediante la actividad de nitrogenasa microbiana (Lindström & Mousavi, 2020; Schwember et al., 2019). El enlace que une los dos átomos de nitrógeno gaseoso (N2) tiene un costo elevado de energía para su ruptura, para romper este triple enlace son necesarias cantidades importantes de energía, para lo cual se requieren 16 moléculas de ATP por N2 reducido (Calvo García, 2011) siguiendo la siguiente reacción:
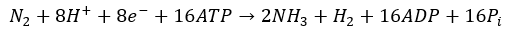
El proceso de infección (nodulación) tiene lugar bajo condiciones de escasez de nitrógeno en el ambiente edáfico que desencadena un sistema molecular de comunicación cruzada entre la raíz de la planta y el rizobio (Maróti & Kondorosi, 2014). Este sistema consiste en compuestos polifenólicos llamados flavonoides que la raíz exuda hacia la rizósfera y se difunden a través de la membrana de los rizobios que allí se desarrollan (Masson-Boivin et al., 2009). Tras la percepción de los flavonoides las células de rizobios responden activando los genes relacionados a simbiosis (nod) y son quimioatraídos hacia la superficie de la raíz (Walker et al., 2020). La inducción de la expresión de los genes nod es mediada por proteínas NodD activadas por flavonoides (Liu & Murray, 2016). Las proteínas NodD de las distintas especies de rizobios se han adaptado para reconocer, de forma específica, a los flavonoides exudados por un espectro limitado de leguminosas hospedadoras (Phour et al., 2020).
La transcripción de los genes nod conduce a la síntesis del factor Nod, un lipo-quito-oligosacárido esencial para el desarrollo de los nódulos (Q. Wang et al., 2018). La estructura química de los lipo-quito-oligosacáridos constituye un factor determinante del espectro de hospedadores con el que los rizobios pueden formar simbiosis, ya que son reconocidos de forma específica por dominios LysM de los receptores localizados en los pelos radiculares de las leguminosas (Gough, 2003; Poole et al., 2018). En consecuencia, ninguna cepa de rizobio es capaz de formar simbiosis con todas las leguminosas y viceversa. El aparecimiento del nódulo radicular responde a un proceso coordinado que implica la señalización por parte de la planta y por parte del microsimbionte, es decir, es un proceso que puede llegar a ser muy específico. Calvo (2011) resume todo este proceso en tres etapas como se muestra en el esquema siguiente (Calvo García, 2011):
- Proceso de reconomiento celular por parte de la bacteria. La planta emite señales, quimioatrayentes, por lo general flavonoides. La bacteria recepta las señales y busca puntos de invación en la raíz emisora.
- La infección de la planta da inicio, la bacteria penetra en la raíz hasta llegar a la corteza de la raíz.
- Establecimiento del simbiosoma (Simbiosis diatrofa).
Sin embargo, Ferrera-Cerrato (2007) menciona un proceso de colonización de los pelos radicales que contempla las siguientes etapas (Ferrera-Cerrato, 2007):
- “La multiplicación de bacterias nodulares en la rizosfera de la leguminosa”.
- “Las raíces de la planta exudan flavonoides que estimulan a las rizobias a producir varios metabolitos nodulares. En este caso, existen numerosos factores nodulares que controlan la especificidad de la colonización”.
- “La adhesión de Rhizobium a los pelos absorbentes de las raíces es favorecida por proteínas bacterianas específicas, llamadas ricadesinas. Estas proteínas interactúan con las lectinas de la leguminosa hospedera, lo que influye en la expresión de los genes de nodulación”.
- “Los pelos absorbentes sufren un enchinamiento con el cual se inicia el hilo de infección hacia las células corticales”.
- “El filamento de colonización llega a la célula tetraploide la cual se diferenciará y formará un nódulo que contendrá los bacteroides rodeados de una membrana peribacteroideal de origen vegetal, diferenciándose así los simbiosomas fijadores de nitrógeno molecular. Esta es una de las simbiosis más útiles estudiadas en la microbiología agrícola”.
Calvo (2011) describe en el primer paso, que las plantas liberan sustancias orgánicas como carbohidratos, ácidos orgánicos, vitaminas, aminoácidos o compuestos fenólicos, en este último caso, los compuestos fenólicos más frecuentes que son exudados son los flavonoides o bioflavonoides, también conocidos como vitamina P y citrina. Los flavonoides al ser una familia diversa de compuestos por sus múltiples isomerías y adición de grupos funcionales a su base permiten exista una verdadera “huella digital” para un determinado microsimbionte, un ejemplo de bioflavonoides son el eriodictiol y la apigenina-7-O-glucósido; estos inducen la nodulación de la agrobacteria Rhizobium leguminosarum.
El proceso de adhesión por parte del microsimbionte tiene lugar en la zona de infección donde se liberaron las glicoproteínas específicas como la ricadesina y las lectinas mismas que atraen a dicho microsimbionte, éste se acerca a la zona de infección y libera un lipopolisacárido denominado factor NOD, este factor induce una serie de deformaciones en los pelos radiculares, a nivel génico la planta dispara la expresión de una serie de proteínas que facilitan al microsimbionte la expresión de sus genes de fijación denominados genes FIX, mismos que permiten al microorganismo reconocer áreas radiculares en donde puede propagar e incorporarse a la planta, el simbionte ingresa al pelo radicular, para colonizarlo, éste debe perder la pared celular y producirse una invaginación en la membrana celular del microsimbionte (Calvo García, 2011; Egelhoff & Long, 1985).
La promoción del desarrollo vegetal y el aumento de la producción de varias especies de leguminosas por parte de los rizobios han sido ampliamente descritos (Giller & Cadisch, 1995; Herridge, 2008). Por ejemplo, el efecto de la fijación biológica de nitrógeno se puede evidenciar en el aumento significativo del número de vainas de plantas de soya (Glycine max L. Merrill) inoculadas con Bradyrhizobium japonicum (Mahmud et al., 2020).
Los beneficios de esta asociación simbiótica entre bacterias y leguminosas no solo presentan un efecto local, sino que puede extenderse a otras especies vegetales. Las leguminosas son capaces de proveer al suelo tanta cantidad de nitrógeno asimilable como los fertilizantes químicos mediante la rizodeposición de este elemento. Esto permite que otras especies vegetales puedan fácilmente absorber este macronutriente (Khan et al., 2002; Mayer et al., 2003; Ta & Faris, 1988).
Van Sambeek & Garrett (2004) reportaron el aumento de 28 % de nitrógeno disponible en suelo de bosque gracias al efecto de la rizodeposición de las leguminosas noduladas por rizobios (van Sambeek & Garrett, 2004). De la misma manera, la alfalfa (Medicago sativa L.), una leguminosa forrajera que se utiliza en el co-cultivo de diferentes especies vegetales, es capaz de proveer de nitrógeno asimilable al suelo gracias a los nódulos que forman los rizobios en sus raíces (Adhikari & Missaoui, 2017; Heichel et al., 1981).
Además del efecto sobre la nutrición mineral de nitrógeno que tienen los rizobios, estas bacterias también son capaces de producir hormonas como: ácido indol-3-acético (Stajković et al., 2011; Zúñiga et al., 2013), citoquininas (Gauthier-Coles et al., 2019) o giberelinas (Foo et al., 2016; McGuiness et al., 2019) que favorecen el desarrollo vegetal, haciendo de estos microorganismos una potencial herramienta biotecnológica de fácil aplicación agrícola sin los efectos nocivos que los fertilizantes químicamente sintetizados ejercen sobre el medio ambiente (Crews & Peoples, 2004).
Solubilización del fósforo y del potasio
En suelos de origen volcánico destaca la característica de inmovilizar fósforo en la superficie de metales amorfos (alofana e imogolita) (Espinoza, n.d.). Comparten, además, propiedades físicas similares como textura franco – arenosa, pH ligeramente ácido (<6) y baja densidad aparente (Ramos-Hernández & Flores-Román, 2008; F. Zúñiga et al., 2016).
Como parte de una respuesta evolutiva a la baja disponibilidad de fósforo en el suelo, una de las estrategias de las plantas, es la asociación de la raíz con microorganismos del suelo que cuenten con la capacidad de mineralizar o solubilizar las fuentes de fósforo (Patiño-Torres & Sanclemente-Reyes, 2014). Según la referencia (Rawat et al., 2021) la solubilización de fosfato inorgánico puede darse mediante producción de ácidos orgánicos, donde se emplea mecanismos como quelación de cationes unidos al fosfato, reducción de pH y formación de complejos con iones metálicos. También, a través de la producción de ácidos inorgánicos para disolver el fósforo y liberación de protones de amoniaco al generar exceso de protón hidrógeno, consecuentemente acidifica el medio que rodea al microorganismo (Rawat et al., 2021). Por otro lado, la solubilización de fosfato orgánico se produce mediante la acción de enzimas que contribuyen a su mineralización (Silva et al., 2023).
Se ha informado de solubilización y mineralización de fósforo por parte de Pseudomonas spp., Agrobacterium spp. y Bacillus circulans (Alori et al., 2017; Babalola & Glick, 2012). En el grupo de hongos, destaca el género Aspergillus, Glomus y Rhizobium (Srinivasan et al., 2012; Tajini et al., 2012). Algunos ejemplos del uso de microorganismos en suelos de origen volcánico se describen a continuación: Investigadores aislaron fosfobacterias como Pseudomonas, Enterobacter y Pantotea; mediante ensayos precisaron que existe mayor liberación de fósforo en tratamientos inoculados, en comparación con controles no inoculados (Jorquera et al., 2008). En otro estudio, realizado sobre suelo derivado de cenizas volcánicas se identificó la acción de Bacillus thuringiensis como solubilizador de fósforo (Delfim et al., 2018). De forma similar, se reporta que Penicillium albidum contribuyó a la nutrición del cultivo evaluado, a través de la mejora de movilización del fosfato en un ensayo con suelo volcánico (Morales et al., 2007).
Hongos micorrícicos
Los hongos micorrícicos son un grupo de hongos que forman una simbiosis mutualista con las raíces de las plantas. Esta asociación, conocida como micorriza, se caracteriza por un intercambio de nutrientes esenciales. Las plantas proporcionan al hongo azúcares y otros compuestos orgánicos, mientras que el hongo facilita la absorción de agua y nutrientes del suelo, especialmente aquellos de baja movilidad como fósforo, zinc y cobre. Los hongos micorrícicos actúan como fertilizantes naturales sin las repercusiones en el suelo y la salud humana que tienen los fertilizantes químicos usados en la agricultura convencional (Flores, 2012).
El estudio de la función de los hongos micorrícicos permite conocer aspectos como su metabolismo, las sustancias que producen, sus necesidades alimenticias y ambientales y la relación que establecen con cada planta.
Estos organismos pueden ser aislados, seleccionados, multiplicados e incorporados al suelo o a las plantas en forma de inóculos. El proceso de inoculación es complejo. Implica diseñar métodos de aislamiento, selección, multiplicación e incorporación adecuados para cada especie o efecto deseado y por otra parte, es necesario determinar las condiciones y técnicas culturales que permitan la manifestación óptima de los efectos (Alarcón & Ferrera Cerrato, 1999).
Tipos de hongos micorrícicos:
Dentro de este grupo de organismos existen dos tipos según donde se sitúan con respecto a las plantas en el medio biofísico y son:
Ectomicorrícicos: Forman una red de micelio alrededor de las raíces de las plantas, sin penetrar en las células. Se encuentran sobre todo en árboles, como pinos, robles y abetos.
Endomicorrícicos: Penetran en las células corticales de las raíces de las plantas, formando estructuras llamadas arbúsculos. Hay muchas plantas, incluyendo gramíneas, leguminosas y hortalizas (Medina, 2016).
Uso de hongos micorrícicos en bioinsumos:
Molina, Mahecha, & Marisol (2004) mencionan que los hongos micorrícicos se utilizan como bioinsumos por sus múltiples beneficios para las plantas y el suelo:
Mejora la absorción de nutrientes: Los hongos micorrícicos extienden su micelio a zonas del suelo que las raíces no pueden alcanzar, aumentando la absorción de agua y nutrientes.
Tolerancia a estrés: Las micorrizas ayudan a las plantas a tolerar condiciones ambientales adversas como sequía, salinidad y temperaturas extremas.
Resistencia a enfermedades: Los hongos micorrícicos pueden estimular el sistema de defensa de las plantas contra patógenos.
Mejora de la estructura del suelo: El micelio de los hongos micorrícicos ayuda a agregar y estabilizar el suelo, mejorando la aireación y la infiltración de agua.
Ejemplos de uso de hongos micorrícicos en bioinsumos:
Inoculantes micorrícicos: Se aplican al suelo o a las semillas para promover la formación de micorrizas en las plantas.
Biofertilizantes: Combinan hongos micorrícicos con otros microorganismos beneficiosos para mejorar la nutrición de las plantas.
Compostaje: Los hongos micorrícicos pueden ser añadidos al compost para acelerar la descomposición de la materia orgánica y mejorar la calidad del compost.
Agentes fitosanitarios y control de plagas
¿Qué es el biocontrol y porqué es importante la investigación de alternativas?
El control biológico de plagas y enfermedades consiste en reducir las poblaciones plaga por medio del uso de enemigos naturales; estos enemigos pueden ser otros insectos benéficos como depredadores y parasitoides, microorganismos como bacterias y hongos o extractos de plantas que cumplen con funciones alelopáticas (Craballos & Guaharay, 2003).
El uso de pesticidas en la producción agrícola genera efectos indeseables en el ambiente que pueden clasificarse en a corto plazo en el ambiente cercano cuando se genera contaminación en el ambiente abiótico, a largo plazo en el ambiente cercano , cuando su uso es permanente y sus efectos persisten durante varios años pese a que cese su uso, y a largo plazo en el ambiente lejano cuando está la presencia de residuos de plaguicidas en los polos de la tierra, su biomagnificación a través de las redes tróficas la extinción de especies y, naturalmente, su presencia en los alimentos, sobre todo de origen animal (miteco.gob.ec, 2023).
Resultados de investigaciones sugieren que la huella ecológica que genera el uso de plaguicidas sintéticos es superior a la que produce el uso de fungicidas y herbicidas orgánicos o de biocontrol, por lo que considerar y desarrollar mecanismos de biocontrol a través de agentes es primordial (Suárez Tamayo & Puerto Rodriguez, 2014).
Agentes Biofitosanitarios
Microorganismos del género Bacillus o Trichoderma han convertido en centro de interés por la producción de metabolitos, que poseen propiedades antifúngicas, e inhiben diversos patógenos como Fusarium, Pythium, Phytophthora, Rhizoztonia, entre muchas otras. Como ejemplo se comprobado que las cepas de Bacillus subtilis tienen un buen efecto controlador sobre el Fusarium sp tanto así que ha tenido un potencial de efectividad entre el 70 a 100% de inhibición. Por notables razones la producción y calidad de los cultivos se ven beneficiadas al disminuir enfermedades de origen fúngico, bacterial y viral (Delgado & Murcia-Ordoñez, 2011).
Bacillus thuringiensis es el insecticida biológico más aplicado en el mundo y se utiliza para controlar diversos insectos que afectan la agricultura. Actualmente se ha descrito que su mecanismo de acción es a través de proteínas Cry, y el estudio de su aplicabilidad ha permitido generar bioinsecticidas de primera generación combinando critsales y esporas de B. thuringiensis (Sauka & Benintende, 2008).
Además, existen varias especies de avispas del orden Hymenopthera, que son parasotides de huevos de plagas de importancia económica como barrenadores del tallo (Diatrea sp.) de hemípteros y lepidópteros plaga (Bernardhr et al., 2011).
Y están los hongos entomopatógenos son un amplio grupo de micro-organismos que proveen múltiples servicios a los sistemas agroecológicos. Entre esos está la capacidad de regular las plagas para mantenerlas en niveles adecuado, tienen mecanismos de invasión únicos, referenciando que no necesitan ser ingeridos por el insecto para controlarlo, sino que lo infectan por contacto y adhesión de las esporas a partes de su cuerpo (partes bucales, membranas intersegmentales o espiráculos, entre otros (Delgado & Murcia-Ordoñez, 2011).
Plaguicidas Biológicos
Los bioplaguicidas o biopesticidas son derivados de materiales naturales como animales, plantas, microorganismos y minerales, son altamente específicos contra las plagas objetivo y generalmente representan poco o ningún riesgo para las personas o el medio ambiente. La investigación y el desarrollo de su aplicación práctica en el campo se enfocan a mitigar la contaminación ambiental causada por residuos de plaguicidas químicos, aunque por su naturaleza biológica también promueven el desarrollo sustentable de la agricultura (Nava et al., 2012).
Según, Chauca & Oñate (2023) en Agrocalidad se encuentran registrados 66 insumos nutricionales alternativos de carácter biológico y 37 insumos fitosanitarios biológicos.
| N | Nombre comercial | Presentación comercial | Composición | Descripción | Fuente |
| 1 | NUTRIKEL ALGAS | Líquido | Simple | Algas 20.00% p/v, mejora el vigor y condición nutricional de los cultivos | https://agrizon.com/products/nutrikel-algas-200-lt |
| 2 | STYMPLEX | Líquido | Simple | Ascophyllum nodosum fresco, bioestimulante | https://cosmoagro.com/wp-content/uploads/2020/11/FICHA-TECNICA-STIMPLEX-7_COLOMBIA.pdf |
| 3 | MIROS | Líquido | Simple | Ascophyllum nodosum fresco, bioestimulante | https://gestion.edifarm.com.ec/edifarm_quickagro/pdfs/productos/MIROS-20181018-115040.pdf |
| 4 | EXTRACTO DE ALGAS MARINAS | Líquido | Simple | Ascophyllum nodosum y Sargassum, bioestimula, previene y corrige situaciones de estrés biótico y abiótico. | https://agroinsumosdelsur.com/producto/extracto-de-algas-500g/ |
| 5 | ALGABLOOM | Líquido | Simple | Se utiliza en la etapa de floración de la planta | https://saltonverde.com/producto/alga-bloom-fertilizante-vegano-de-algas-para-floracion-plagron/ |
| 6 | ALGAREN | Líquido | Simple | Algas Ecklonia máxima, promotor natural del crecimiento | https://www.buscador.portaltecnoagricola.com/vademecum/esp/producto/5704/ALGAREN |
| 7 | SUPER FIFTY | Líquido | Simple | Ascophyllum nodosum, uso foliar y fertirrigación | https://summit-agro.com/pe/es/wp-content/uploads/2022/06/TECHNICAL-DATA-SUPER-FIFTY-PRIME-v1.pdf |
| 8 | FORCRAL | Líquido | Simple | Algas 20% L, Ascophyllum nodosum, uso foliar y fertirrigación | https://www.buscador.portaltecnoagricola.com/vademecum/mex/producto/FORCRAL |
| 9 | VIGORATE ALGAS | Líquido | Simple | Algas 20% L, Ascophyllum nodosum, mejora el vigor y condición nutricional de los cultivos | https://agrizon.com/products/vigorate-algas-200-lt-2?v=1f53c303679e |
| 10 | FOLIQUEL ALGAS | Líquido | Simple | Algas marinas 12.6 %, estimulante | https://agrodesa.com/inicio/pdf/ficha_folikelp.pdf |
| 11 | BACTOX SL | Líquido | Simple | Esporas viables de Bacillus subtilis (17,5%), controla enfermedades causadas por hongos y bacterias | https://agroactivocol.com/wp-content/uploads/2021/04/bactox.pdf |
| 12 | BACTHON SC | Líquido | Mixto | Azospirillum brasilense, Azotobacter chroococcum, Lactobacillus acidophillus, Saccharomyces cerevisiae. Inoculante biotecnológico que desintoxica el suelo agrícola y las raíces de las toxinas, alcoholes, amonios y agroquímicos | https://www.orbiotec.com/web/ftecnica/30-bacthon-sc-ficha-tecnica.pdf |
| 13 | SOIL ACTIVATOR TM | Sólido | Mixto | Bacillus subtilis + Bacillus amyloliquefaciens + Pseudomonas monteilli, | https://agrogamacolombia.com.co/wp-content/uploads/2018/04/EarthAlive_SoilActivator_TDS_2017_ES.pdf |
| 14 | DIGESTOR SC | Líquido | Mixto | Azospirillum brasilense, Azotobacter chroococcum, Lactobacillus acidophillus, Saccharomyces cerevisae y Enzimas Microbianas. Inoculante Biotecnológico con alta actividad para digerir la materia orgánica fresca o fermentada | https://jwasociados.com.ec/wp-content/uploads/orius_ficha-tecnica_digestor.pdf |
| 15 | RESID MG | Sólido | Simple | Bioestimulante microgranulado que contiene la exclusiva especie de hongo formador de micorrizas Glomus iranicum var. tenuihypharum | https://symborg.com/es/bioestimulantes/resid-mg/ |
| 16 | RIZOFOS LIQ MAIZ | Líquido | Simple | Biofertilizante promotor del crecimiento vegetal a base de Pseudomonas fluorescens | https://www.rizobacter.com/es/productos/uruguay/rizofos-liq-maiz |
| 17 | RIZOLIQ | Líquido | Simple | Cepas de bacterias fijadoras de N, Bradyrhizobium sp | https://www.rizobacter.com.ar/es/productos/argentina/rizoliq |
| 18 | MESTEÑO | Líquido | Simple | Bacillus sp. Pseudomonas sp, activador y potenciador radicular | https://www.alabama.com.pe/soluplant-meste%C3%B1o |
| 19 | TRICHOBIOL | Líquido | Simple | Biofungicida de origen microbiológico para le control de enfermedades causadas por hongos del suelo y foliares | https://greencorp.mx/producto/biocontrol/biofungicidas/trichobiol/ |
| 20 | RESID HC | Sólido | Mixto | Bioestimulante desarrollado para el tratamiento de semillas de cereales y cultivos de grano, compuesto por Glomus iranicum var. tenuihypharum | https://symborg.com/es/bioestimulantes/resid-hc/ |
| 21 | BIO-TRICH | Sólido | Simple | Es un biofungicida y bioestimulante a base de esporas del hongo Trichoderma harzianun | https://www.agearthecuador.org/wp2020/product/biotrich/ |
| 22 | Q BIO COMPOSTER MIX | Sólido | Simple | Bacillus subtillus, Bacillus amyloliquefaciens Bacillus Pumilus, Bacillus Megaterium, Bacillus licheniformis Pseudomona Putida, Pseudomona Fluorescente, Trichoderma (Reesei) Aspergillus (Niger) conjuntamente con enzimas lipasa Proteasa, amilasa y celulasa. Acondicionador biológico de suelos | https://qualityec.com/product/q-bio-composter-mix/ |
| 23 | DORA AMINO ACIDS 80% | Sólido | Mixto | Bioestimulante de aplicación foliar y edáfica | https://agripac.com.ec/productos/dora-aminoacid-80/#:~:text=DORA%20Amino%20Acids%2080%25%20es,el%20m%C3%A9todo%20de%20hidr%C3%B3lisis%20enzim%C3%A1tica. |
| 24 | BIO CALCIO BORON SL | Líquido | Mixto | Evita la caída de flores, frutos y favorece el cuaje, engrose y calidad del fruto | https://gestion.edifarm.com.ec/edifarm_quickagro/pdfs/productos/BIO%20CALCIOBORON%20SL-20181017-161805.pdf |
| 25 | MYCOUP | Sólido | Mixto | Bioestimulante compuesto de Hongo Formador de Micorrizas Arbusculares Glomus iranicum var. tenuihypharum. | https://symborg.com/es/bioestimulantes/mycoup/ |
| N | Nombre comercial | Principio activo | Presentación comercial | Categoría toxicológica |
| 1 | BTB | Bacillus thuringiensis var.thuringiensis 9 % | Foliar | Categoría IV |
| 2 | BACTICIDE | Bacillus thuringiensis var.thuringiensis 9 % | Foliar | Categoría IV |
| 3 | MILSANA | Extracto de reynoutria sachalinensis 5 % | Semilla | Categoría IV |
| 4 | SONATA | Bacillus pumilus strain qst 2808 1.38 % | Foliar | Categoría IV |
| 5 | BACTOFIT | Bacillus subtilis gb03 35-40 G/KG | Foliar | Categoría IV |
| 6 | VITIGRAN AZUL | Myrothecium verrucaria 600 G/KG | Foliar | Categoría III |
| 7 | SERIFEL | Bacillus amyloliquefaciens cepa MBI 600 100 G/L | Foliar | Categoría IV |
| 8 | SERENADE 1.34 SC | Bacillus subtilis cepa qst 713 13.4 G/L | Foliar | Categoría IV |
| 9 | RHAPSODY 1,34 SC | Bacillus subtilis cepa qst 713 13.4 G/L | Foliar | Categoría IV |
| 10 | REGALIA 20 | Extracto de reynoutria sachalinensis 200 G/L | Foliar | Categoría IV |
| 11 | DIPEL 2X ; DIPEL DF | Bacillus thuringiensis 6.4 % | Foliar | Categoría IV |
| 12 | DIPEL 8 L ; DIPEL ES | Bacillus thuringiensis 3.5 % | Foliar | Categoría IV |
| 13 | NEW BT 2X ; BIOLEP 2X | Bacillus thuringiensis var. Kurstaki 64 G/KG | Foliar | Categoría IV |
| 14 | MICOSPLAG ; FUNGIO | Beauveria bassiana 100 UFC/G U + Metarhizium anisopliae 100 UFC/G U + Paecilomyces lilacinus 200 UFC/G U | Foliar | Categoría IV |
| 15 | BIOCATCH | Verticillium lecanii 1 X 10 9 UFC/ML ML | Foliar | Categoría IV |
| 16 | NEW BT-8 L ; BIOLEP 8L | Bacillus thuringiensis var. Kurstaki 35 G/L | Foliar | Categoría IV |
| 17 | NEWBT 48 LC | Bacillus thuringiensis 21,5 G/L | Semilla | Categoría IV |
| 18 | TURILAV | Bacillus thuringiensis 32 G/KG | Foliar | Categoría IV |
| 19 | LARVO B.T. | Bacillus thuringiensis 26.4 % | Foliar | Categoría IV |
| 20 | ECOTECH PRO | Bacillus thuringiensis 24.25 % | Foliar | Categoría IV |
Estudio de caso
“Capacitación De Productores En Investigación-Acción: Estudio De Caso Del Control Biológico Del Minador De La Hoja De Los Cítricos (Phyllocnistis citrella Stainton) En Agroecosistemas De Veracruz”
Hacia el año 2000 en el estado de Veracruz en México existían 792 ha cultivadas de Toronja. El minador de la hoja de los cítricos Phyllocnistis citrella stainton, es una plaga de introducción que daña al follaje, retarda el crecimiento de los árboles, disminuye el rendimiento, y provoca una mala presentación del fruta de toronja, y está presente todo el año, aunque su población se incrementa de marzo a mayo. Para entonces, la información que poseían los productores con respecto al manejo de esta plaga era muy escaza, por lo que el objeto de este estudio fue capacitar en control biológico, con base en el parasitoide Ageniaspis citricola Logvinovskaya, y otros parasitoides nativos, como herramienta para controlar al minador de la hoja de los cítricos, basado en resultados de Australia y Florida, para evitar que a través de herramientas de control convencional se erosionen los ecosistemas aledaños a las áreas fruticultoras. Puesto que, el cultivo de toronja representaba para los productores casi el 80% de sus ingresos, romper el paradigma del control tradicional representó un reto, sin embargo, el estudio de la situación de los productores se realizó exitosamente gracias a la aplicación de encuestas, gracias a las que se reveló que el 86% de los productores eran hombres, sólo una de las dos mujeres asistió a la plática informativa, después, asistió en su representación el encargado del manejo de la finca o su ranchero, además la mayoría utilizaba riesgo por aspersión, además, que la edad podía ser un factor que afectaba la forma en que se promovía la incorporación de nuevas y mejores técnicas o actividades agrícolas, encaminadas a mejorar la rentabilidad o sanidad del cultivo de toronja u otros cítricos, además de que más del 50% consideraba que los métodos de control biológico eran “malos” o poco efectivos. El método para poder llevar a cabo la investigación fue la de capacitación- acción que consiste en instruir a los productores mientras van haciendo práctica y evaluando los resultados de sus prácticas. Sin embargo, luego de asistir a las escuelas de capacitación, a todos, el control biológico del minador por el parasitoide Ageniaspis citricola, les pareció un proyecto interesante. Para 28.5% de los productores, el interés en participar en dicho proyecto se basaría en conocer las ventajas económicas del mismo y se interesaron en seguir capacitándose. La estrategia de capacitación-acción promovió cambios positivos tanto en aptitud como en actitud de los productores hacia el manejo del minador de la hoja de los cítricos mediante control biológico.
Conclusiones
Los suelos, especialmente los de origen volcánico como los de la sierra ecuatoriana, a pesar de su baja disponibilidad de fósforo, presentan características que favorecen la simbiosis entre plantas y microorganismos. Esta interacción permite la solubilización y mineralización del fósforo a través de diferentes mecanismos, como la producción de ácidos orgánicos e inorgánicos, enzimas y la acción de bacterias y hongos específicos.
Los Rhizobium son bacterias esenciales para la fijación biológica de nitrógeno. Esta interacción simbiótica con las leguminosas juega un papel fundamental en la agricultura sostenible, la fertilidad del suelo y la protección del medio ambiente. La FBN y la simbiosis Rhizobium-leguminosas son ejemplos de la importancia de la biodiversidad para la agricultura sostenible y la salud del planeta.
Los hongos micorrícicos son una opción viable para generar agricultura alternativa, sus funciones biológicas pueden ser de gran utilidad en el agro. Su campo de estudio se sigue desarrollando, pero ya existen casos donde su aplicación en las distintas prácticas de manejos de cultivos o en la preservación de áreas de conservación ha resultado de forma positiva.
Existen algunos géneros de microorganismos cuyo potencial para control biológico no ha sido desarrollado a profundidad todavía (como Gliocladium), por lo que hacer énfasis en su caracterización para el desarrollo de nuevos biocidas es fundamental como una de las herramientas de cara al cambio climático.
Referencias
Adhikari, L., & Missaoui, A. M. (2017). Nodulation response to molybdenum supplementation in alfalfa and its correlation with root and shoot growth in low pH soil. Journal of Plant Nutrition, 40(16), 1–39. https://doi.org/10.1080/01904167.2016.1264601
Alarcón, A., & Ferrera Cerrato, R. (1999). Manejo de la micorriza arbuscular en sistemas de propagación de plantas frutícolas. Terra Latinoamericana, 17(3), 179-191.
Alori, E. T., Glick, B. R., & Babalola, O. O. (2017). Microbial Phosphorus Solubilization and Its Potential for Use in Sustainable Agriculture. Frontiers in Microbiology, 8. https://doi.org/10.3389/fmicb.2017.00971
Babalola, O., & Glick, B. (2012). The use of microbial inoculants in African agriculture: current practice and future prospects. J. Food Agric. Environ, 10(3 & 4), 540–549.
Backer, R., Rokem, J. S., Ilangumaran, G., Lamont, J., Praslickova, D., Ricci, E., Subramanian, S., & Smith, D. L. (2018). Plant Growth-Promoting Rhizobacteria: Context, Mechanisms of Action, and Roadmap to Commercialization of Biostimulants for Sustainable Agriculture. Frontiers in Plant Science, 9, 1–17. https://doi.org/10.3389/fpls.2018.01473
Bernal, G., & Graham, P. (2001). Diversity in the rhizobia associated with Phaseolus vulgaris L. in Ecuador, and comparisons with Mexican bean rhizobia. Canadian Journal of Microbiology, 47(6), 526–534. https://doi.org/10.1139/W01-037
Bernardhr, M. F., Manzano, M., & Vargas, G. (2011). Uso de parasitoides en el control biológico de insectos plaga en Colombia. In Agentes de Control biológico (Vol. 1, pp. 489–500).
Boyd, E. S., & Peters, J. W. (2013). New insights into the evolutionary history of biological nitrogen fixation. Frontiers in Microbiology, 4. https://doi.org/10.3389/fmicb.2013.00201
Bullor, L., Braude, H., Monzón, J., Cotes Prado, A. M., Casavola, V., Carbajal Morón., N. y Risopoulos, J. 2023. Bioinsumos: Oportunidades de inversión en América Latina – Direcciones de inversión No. 9. Roma, FAO. https://doi.org/10.4060/cc9060es
Castillo, H., Rojas, R., & Villalta, M. (2016). Gliocladium sp., agente biocontrolador con aplicaciones prometedoras. Revista Tecnología En Marcha, 26(9), 33–38.
Celis, Á., Mendoza, C., & Pachón, M. (2008). Extractos vegetales utilizados como biocontroladores con énfasis en la familia Piperaceae. Agronomía Colombiana, 13(2), 76–87.
Chauca, S., & Oñate, J. (2023). Estado del arte de la oferta y disponibilidad de los insumos agropecuarios alternativos (orgánicos, minerales y biológicos) a los convencionales (agroquímicos) en Ecuador [Universidad Central del Ecuador]. https://www.dspace.uce.edu.ec/entities/publication/www.dspace.uce.edu.ec
Chávez, M. A., & Vásquez, J. E. (2021). Efecto de la aplicación de tres dosis de Bacillus subtilis en tres variedades de fréjol arbustivo. Siembra, 8(2). https://doi.org/10.29166/siembra.v8i2.2657
Cherkasov, N., Ibhadon, A. O., & Fitzpatrick, P. (2015). A review of the existing and alternative methods for greener nitrogen fixation. Chemical Engineering and Processing: Process Intensification, 90. https://doi.org/10.1016/j.cep.2015.02.004
Craballos, M., & Guaharay, H. (2003). Control biológico de plagas agrícolas (Vol. 1).
Crews, T. E., & Peoples, M. B. (2004). Legume versus fertilizer sources of nitrogen: Ecological tradeoffs and human needs. Agriculture, Ecosystems and Environment, 102(3), 279–297. https://doi.org/10.1016/j.agee.2003.09.018
Cuesta, G., & Mondaca, E. (2014). Efecto de un biorregulador a base de auxinas sobre el crecimiento de plantines de tomate. Revista Chapingo. Serie horticultura, 20(2), 215-222.
Darnajoux, R., Magain, N., Renaudin, M., Lutzoni, F., Bellenger, J.-P., & Zhang, X. (2019). Molybdenum threshold for ecosystem scale alternative vanadium nitrogenase activity in boreal forests. Proceedings of the National Academy of Sciences, 116(49). https://doi.org/10.1073/pnas.1913314116
Debnath, S., Chakraborty, G., Dutta, S. S., Chaudhury, S. R., Das, P., & Saha, A. K. (2020). Potencial de especies de Trichoderma como biofertilizante y control biológico en el cultivo de Oryza sativa L. Biotecnología Vegetal, 20(1), 1-16.
de Lajudie, P., & Young, J. P. W. (2020a). International committee on systematics of prokaryotes subcommittee on the taxonomy of rhizobia and agrobacteria minutes of the closed meeting by videoconference, 17 July 2019. International Journal of Systematic and Evolutionary Microbiology, 70(5), 3563–3571. https://doi.org/10.1099/IJSEM.0.004157/CITE/REFWORKS
de Lajudie, P., & Young, P. (2020b). International Committee on Systematics of Prokaryotes Subcommittee on the Taxonomy of Rhizobia and Agrobacteria Minutes of the closed meeting by videoconference, 17 July 2019 . International Journal of Systematic and Evolutionary Microbiology, 70, 3563–3571. https://doi.org/10.1099/ijsem.0.004157
Delfim, J., Schoebitz, M., Paulino, L., Hirzel, J., & Zagal, E. (2018). Phosphorus Availability in Wheat, in Volcanic Soils Inoculated with Phosphate-Solubilizing Bacillus thuringiensis. Sustainability, 10(2), 144. https://doi.org/10.3390/su10010144
Dreyfus, B., Garcia, J. L., & Gillis, M. (1988). Characterization of Azorhizobium caulinodans gen. nov., sp. nov., a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania rostrata. International Journal of Systematic Bacteriology, 38(1), 89–98. https://doi.org/10.1099/00207713-38-1-89/CITE/REFWORKS
Dubey, A., Malla, M. A., Khan, F., Chowdhary, K., Yadav, S., Kumar, A., Sharma, S., Khare, P. K., & Khan, M. L. (2019). Soil microbiome: a key player for conservation of soil health under changing climate. Biodiversity and Conservation, 28(8–9). https://doi.org/10.1007/s10531-019-01760-5
Egelhoff, T. T., & Long, S. R. (1985). Rhizobium meliloti nodulation genes: identification of nodDABC gene products, purification of nodA protein, and expression of nodA in Rhizobium meliloti. Journal of Bacteriology, 164(2), 591–599.
Espinoza, J. (n.d.). Fijación de fósforo en suelos derivados de ceniza volcánica. INFOBOS.
Ferrera-Cerrato, R. (2007). Microbiología Agrícola: Hongos, bacterias micro y macrofauna, control biológico y planta-microorganismo (1ra ed., Issue Sirsi) i9789682478109). México Editorial Trillas.
Fierer, N. (2017). Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Reviews Microbiology, 15(10). https://doi.org/10.1038/nrmicro.2017.87
Flores, S. (01 de 10 de 2012). Hongos micorrizógenos, clave para el desarrollo de la agricultura orgánica. Obtenido de Ciencia UNAM: https://ciencia.unam.mx/leer/110/Hongos_micorrizogenos_clave_para_el_desarrollo_de_la_agricultura_organica
Foo, E., McAdam, E. L., Weller, J. L., & Reid, J. B. (2016). Interactions between ethylene, gibberellins, and brassinosteroids in the development of rhizobial and mycorrhizal symbioses of pea. Journal of Experimental Botany, 67(8), 2413–2424. https://doi.org/10.1093/jxb/erw047
Garrity, G. (2007). Bergey’s Manual® of Systematic Bacteriology: Volume 2: The Proteobacteria, Part B: The Gammaproteobacteria. Springer Science & Business Media.
Gauthier-Coles, C., White, R. G., & Mathesius, U. (2019). Nodulating legumes are distinguished by a sensitivity to cytokinin in the root cortex leading to pseudonodule development. Frontiers in Plant Science, 9, 1–14. https://doi.org/10.3389/fpls.2018.01901
Giller, K. E., & Cadisch, G. (1995). Future benefits from biological nitrogen fixation: An ecological approach to agriculture. Plant and Soil, 174, 255–277.
Gough, C. (2003). Rhizobium Symbiosis: Insight into Nod Factor Receptors. Current Biology, 13(24), 973–975. https://doi.org/10.1016/j.cub.2003.11.047
Gupta, V. V. S. R., Zhang, B., Penton, C. R., Yu, J., & Tiedje, J. M. (2019). Diazotroph Diversity and Nitrogen Fixation in Summer Active Perennial Grasses in a Mediterranean Region Agricultural Soil. Frontiers in Molecular Biosciences, 6. https://doi.org/10.3389/fmolb.2019.00115
Heichel, G. H., Barnes, D. K., & Vance, C. P. (1981). Nitrogen Fixation of Alfalfa in the Seeding Year. Crop Science, 21(2), 330–335.
Herridge, D. F. (2008). Chapter 4: Inoculation Technology for Legumes. In M.J. Dilworth et al. (Ed.), Nitrogen-fixing Leguminous Symbioses (pp. 77–115). Springer Science+Business Media B.V,.
Hoffman, B. M., Lukoyanov, D., Yang, Z.-Y., Dean, D. R., & Seefeldt, L. C. (2014). Mechanism of Nitrogen Fixation by Nitrogenase: The Next Stage. Chemical Reviews, 114(8). https://doi.org/10.1021/cr400641x
Jaiswal, S. K., Mohammed, M., Ibny, F. Y. I., & Dakora, F. D. (2021). Rhizobia as a Source of Plant Growth-Promoting Molecules: Potential Applications and Possible Operational Mechanisms. Frontiers in Sustainable Food Systems, 4(1), 1–14. https://doi.org/10.3389/fsufs.2020.619676
Jorquera, M. A., Hernández, M. T., Rengel, Z., Marschner, P., & de la Luz Mora, M. (2008). Isolation of culturable phosphobacteria with both phytate-mineralization and phosphate-solubilization activity from the rhizosphere of plants grown in a volcanic soil. Biology and Fertility of Soils, 44(8), 1025–1034. https://doi.org/10.1007/s00374-008-0288-0
Khan, D., Peoples, M. B., & Herridge, D. F. (2002). 3 NSW Agriculture, Tamworth Centre for Crop Improvement. Plant and Soil, 245(4), 327–334.
Kneip, C., Lockhart, P., Voß, C., & Maier, U.-G. (2007). Nitrogen fixation in eukaryotes – New models for symbiosis. BMC Evolutionary Biology, 7(1), 1–12. https://doi.org/10.1186/1471-2148-7-55
Köberl, M., Wagner, P., Müller, H., Matzer, R., Unterfrauner, H., Cernava, T., & Berg, G. (2020). Unraveling the Complexity of Soil Microbiomes in a Large-Scale Study Subjected to Different Agricultural Management in Styria. Frontiers in Microbiology, 11. https://doi.org/10.3389/fmicb.2020.01052
Kuypers, M. M. M., Marchant, H. K., & Kartal, B. (2018). The microbial nitrogen-cycling network. Nature Reviews Microbiology, 16(5). https://doi.org/10.1038/nrmicro.2018.9
Kuzmanović, N., Biondi, E., Overmann, J., Puławska, J., Verbarg, S., Smalla, K., & Lassalle, F. (2020). Revisiting the taxonomy of Allorhizobium vitis (i.e. Agrobacterium vitis) using genomics – emended description of All. vitis sensu stricto and description of Allorhizobium ampelinum sp. nov. BioRxiv, 2020.12.19.423612. https://doi.org/10.1101/2020.12.19.423612
Lei, S., Pulakat, L., & Gavini, N. (2000). Activation of vanadium nitrogenase expression in Azotobacter vinelandii DJ54 revertant in the presence of molybdenum. FEBS Letters, 482(1–2). https://doi.org/10.1016/S0014-5793(00)02052-4
Li, X., Jousset, A., de Boer, W., Carrión, V. J., Zhang, T., Wang, X., & Kuramae, E. E. (2019). Legacy of land use history determines reprogramming of plant physiology by soil microbiome. The ISME Journal, 13(3). https://doi.org/10.1038/s41396-018-0300-0
Lindström, K., & Mousavi, S. A. (2020). Effectiveness of nitrogen fixation in rhizobia. Microbial Biotechnology, 13(5). https://doi.org/10.1111/1751-7915.13517
Liu, C.-W., & Murray, J. (2016). The Role of Flavonoids in Nodulation Host-Range Specificity: An Update. Plants, 5(33), 1–13. https://doi.org/10.3390/plants5030033
Mahmud, K., Makaju, S., Ibrahim, R., & Missaoui, A. (2020). Current Progress in Nitrogen Fixing Plants and Microbiome Research. Plants, 9(1), 1–17. https://doi.org/10.3390/plants9010097
Mamani de Marchese, A., & Filippone, M. (2018). Bioinsumos: Componentes claves de una agricultura sostenible. Revista agronómica del noroeste argentino, 38(1), 9-21.
Maróti, G., & Kondorosi, E. (2014). Nitrogen-fixing Rhizobium-legume symbiosis: are polyploidy and host peptide-governed symbiont differentiation general principles of endosymbiosis? Frontiers in Microbiology, 5. https://doi.org/10.3389/fmicb.2014.00326
Masson-Boivin, C., Giraud, E., Perret, X., & Batut, J. (2009). Establishing nitrogen-fixing symbiosis with legumes: how many rhizobium recipes? Trends in Microbiology, 17(10). https://doi.org/10.1016/j.tim.2009.07.004
Medina, L. (2016). Revisión bibliográfica LA AGRICULTURA, LA SALINIDAD Y LOS HONGOS MICORRÍZICOS ARBUSCULARES꞉ UNA NECESIDAD, UN PROBLEMA Y UNA ALTERNATIVA. Cultivos Tr
Mayer, J., Buegger, F., Steen Jensen, E., Schloter, M., & Heß, J. (2003). Estimating N rhizodeposition of grain legumes using a 15 N in situ stem labelling method. Soil Biology & Biochemistry, 35, 21–28.
McGuiness, P. N., Reid, J. B., & Foo, E. (2019). The role of gibberellins and brassinosteroids in nodulation and arbuscular mycorrhizal associations. In Frontiers in Plant Science (Vol. 10, pp. 1–7). Frontiers Media S.A. https://doi.org/10.3389/fpls.2019.00269
miteco.gob.ec. (2023). Ministerio de transición ecológica de España. Impacto de Los Nitratos y Pesticidas En Procesos Productivos . https://www.miteco.gob.es/es/agua/temas/estado-y-calidad-de-las-auas/proteccion-nitratos-pesticidas/impacto-calidad-agua.html
Morales, A., Alvear, M., Valenzuela, E., Rubio, R., & Borie, F. (2007). Effect of inoculation withPenicillium albidum, a phosphate-solubilizing fungus, on the growth ofTrifolium pratense cropped in a volcanic soil. Journal of Basic Microbiology, 47(3), 275–280. https://doi.org/10.1002/jobm.200610255
Mousavi, S. A., Österman, J., Wahlberg, N., Nesme, X., Lavire, C., Vial, L., Paulin, L., de Lajudie, P., & Lindström, K. (2014). Phylogeny of the Rhizobium–Allorhizobium–Agrobacterium clade supports the delineation of Neorhizobium gen. nov. Systematic and Applied Microbiology, 37(3), 208–215. https://doi.org/10.1016/J.SYAPM.2013.12.007
Mus, F., Crook, M. B., Garcia, K., Garcia Costas, A., Geddes, B. A., Kouri, E. D., Paramasivan, P., Ryu, M.-H., Oldroyd, G. E. D., Poole, P. S., Udvardi, M. K., Voigt, C. A., Ané, J.-M., & Peters, J. W. (2016). Symbiotic Nitrogen Fixation and the Challenges to Its Extension to Nonlegumes. Applied and Environmental Microbiology, 82(13). https://doi.org/10.1128/AEM.01055-16
Nag, P., Shriti, S., & Das, S. (2020). Microbiological strategies for enhancing biological nitrogen fixation in nonlegumes. Journal of Applied Microbiology, 129(2). https://doi.org/10.1111/jam.14557
Nava, E., García, C., Camacho, J. R., & Vázquez, E. L. (2012). Bioplaguicidas: Una opción para el control biológico de plagas. Ra Ximhai, 8(3), 17-29.
Pankievicz, V. C. S., Irving, T. B., Maia, L. G. S., & Ané, J.-M. (2019). Are we there yet? The long walk towards the development of efficient symbiotic associations between nitrogen-fixing bacteria and non-leguminous crops. BMC Biology, 17(1). https://doi.org/10.1186/s12915-019-0710-0
Patiño-Torres, C., & Sanclemente-Reyes, O. (2014). Los microorganismos solubilizadores de fósforo (MSF): una alternativa biotecnológica para una agricultura sostenible. Entramado, 10(2), 288–297.
Peng, T., Xu, Y., & Zhang, Y. (2018). Comparative genomics of molybdenum utilization in prokaryotes and eukaryotes. BMC Genomics, 19(1). https://doi.org/10.1186/s12864-018-5068-0
Phour, M., Sehrawat, A., Sindhu, S. S., & Glick, B. R. (2020). Interkingdom signaling in plant-rhizomicrobiome interactions for sustainable agriculture. Microbiological Research, 241. https://doi.org/10.1016/j.micres.2020.126589
Poole, P., Ramachandran, V., & Terpolilli, J. (2018). Rhizobia: from saprophytes to endosymbionts. Nature Reviews Microbiology, 16(5). https://doi.org/10.1038/nrmicro.2017.171
Ramírez-Puebla, S. T., Hernández, M. A. R., Guerrero Ruiz, G., Ormeño-Orrillo, E., Martinez-Romero, J. C., Servín-Garcidueñas, L. E., Núñez-de la Mora, A., Amescua-Villela, G., Negrete-Yankelevich, S., & Martínez-Romero, E. (2019). Nodule bacteria from the cultured legume Phaseolus dumosus (belonging to the Phaseolus vulgaris cross-inoculation group)with common tropici phenotypic characteristics and symbiovar but distinctive phylogenomic position and chromid. Systematic and Applied Microbiology, 42(3), 373–382. https://doi.org/10.1016/J.SYAPM.2018.12.007
Ramos-Hernández, S., & Flores-Román, D. (2008). Comparación de dos fuentes fosfatadas en suelos volcánicos cultivados con café del soconusco, Chiapas, México. Agrociencia, 42(4), 391–398.
Rawat, P., Das, S., Shankhdhar, D., & Shankhdhar, S. C. (2021). Phosphate-Solubilizing Microorganisms: Mechanism and Their Role in Phosphate Solubilization and Uptake. Journal of Soil Science and Plant Nutrition, 21(1), 49–68. https://doi.org/10.1007/s42729-020-00342-7
Rivas, R., Willems, A., Palomo, J. L., García-Benavides, P., Mateos, P. F., Martínez-Molina, E., Gillis, M., & Velázquez, E. (2004). Bradyrhizobium betae sp. nov., isolated from roots of Beta vulgaris affected by tumour-like deformations. International Journal of Systematic and Evolutionary Microbiology, 54(4), 1271–1275. https://doi.org/10.1099/IJS.0.02971-0/CITE/REFWORKS
Rivas, R., Willems, A., Subba-Rao, N. S., Mateos, P. F., Dazzo, F. B., Kroppenstedt, R. M., Martínez-Molina, E., Gillis, M., & Velázquez, E. (2003). Description of Devosia neptuniae sp. nov. that nodulates and fixes nitrogen in symbiosis with Neptunia natans, an aquatic legume from India. Systematic and Applied Microbiology, 26(1), 47–53. https://doi.org/10.1078/072320203322337308
Sauka, D., & Benintende, G. (2008). Bacillus thuringiensis: generalidades. Un acercamiento a su empleo en el biocontrol de insectos lepidópteros que son plagas agrícolas. Revista Argentina de Microbiología, 40(2).
Schwember, A. R., Schulze, J., del Pozo, A., & Cabeza, R. A. (2019). Regulation of Symbiotic Nitrogen Fixation in Legume Root Nodules. Plants, 8(9). https://doi.org/10.3390/plants8090333
Shamseldin, A., Abdelkhalek, A., & Sadowsky, M. J. (2017). Recent changes to the classification of symbiotic, nitrogen-fixing, legume-associating bacteria: a review. Symbiosis, 71(2), 91–109. https://doi.org/10.1007/s13199-016-0462-3
Silva, L., Pereira, M., Carvalho, A., Buttrós, V., Pasqual, M., & Dória, J. (2023). Phosphorus-Solubilizing Microorganisms: A Key to Sustainable Agriculture. Agriculture, 13(2), 462.
Srinivasan, R., Yandigeri, M. S., Kashyap, S., & Alagawadi, A. R. (2012). Effect of salt on survival and P-solubilization potential of phosphate solubilizing microorganisms from salt affected soils. Saudi Journal of Biological Sciences, 19(4), 427–434. https://doi.org/10.1016/j.sjbs.2012.05.004
Stajković, O., Delić, D., Jošić, D., Kuzmanović, Đ., Rasulić, N., & Knežević-Vukčević, J. (2011). Improvement of common bean growth by co-inoculation with Rhizobium and plant growth-promoting bacteria. Romanian Biotechnological Letters, 16(1), 5919–5926.
Suárez Tamayo, S., & Puerto Rodriguez, A. (2014). Efectos de los plaguicidas sobre el ambiente y la salud. Revista Cubana de Ciencias Médicas, 17(2).
Sy, A., Giraud, E., Jourand, P., Garcia, N., Willems, A., De Lajudie, P., Prin, Y., Neyra, M., Gillis, M., Boivin-Masson, C., & Dreyfus, B. (2001). Methylotrophic Methylobacterium bacteria nodulate and fix nitrogen in symbiosis with legumes. Journal of Bacteriology, 183(1), 214–220. https://doi.org/10.1128/JB.183.1.214-220.2001
Sylvia, D. M., Furhrmann, J. J., Hartel, P. G., & Zuberer, D. A. (1999). Principles and applications of soil microbiology. Prentice-Hall.
Adhikari, L., & Missaoui, A. M. (2017). Nodulation response to molybdenum supplementation in alfalfa and its correlation with root and shoot growth in low pH soil. Journal of Plant Nutrition, 40(16), 1–39. https://doi.org/10.1080/01904167.2016.1264601
Alori, E. T., Glick, B. R., & Babalola, O. O. (2017). Microbial Phosphorus Solubilization and Its Potential for Use in Sustainable Agriculture. Frontiers in Microbiology, 8. https://doi.org/10.3389/fmicb.2017.00971
Babalola, O., & Glick, B. (2012). The use of microbial inoculants in African agriculture: current practice and future prospects. J. Food Agric. Environ, 10(3 & 4), 540–549.
Backer, R., Rokem, J. S., Ilangumaran, G., Lamont, J., Praslickova, D., Ricci, E., Subramanian, S., & Smith, D. L. (2018). Plant Growth-Promoting Rhizobacteria: Context, Mechanisms of Action, and Roadmap to Commercialization of Biostimulants for Sustainable Agriculture. Frontiers in Plant Science, 9, 1–17. https://doi.org/10.3389/fpls.2018.01473
Bernal, G., & Graham, P. (2001). Diversity in the rhizobia associated with Phaseolus vulgaris L. in Ecuador, and comparisons with Mexican bean rhizobia. Canadian Journal of Microbiology, 47(6), 526–534. https://doi.org/10.1139/W01-037
Boyd, E. S., & Peters, J. W. (2013). New insights into the evolutionary history of biological nitrogen fixation. Frontiers in Microbiology, 4. https://doi.org/10.3389/fmicb.2013.00201
Calvo García, S. (2011). Bacterias simbióticas fijadoras de nitrógeno. CT, 3, 173–186.
Cherkasov, N., Ibhadon, A. O., & Fitzpatrick, P. (2015). A review of the existing and alternative methods for greener nitrogen fixation. Chemical Engineering and Processing: Process Intensification, 90. https://doi.org/10.1016/j.cep.2015.02.004
Crews, T. E., & Peoples, M. B. (2004). Legume versus fertilizer sources of nitrogen: Ecological tradeoffs and human needs. Agriculture, Ecosystems and Environment, 102(3), 279–297. https://doi.org/10.1016/j.agee.2003.09.018
Darnajoux, R., Magain, N., Renaudin, M., Lutzoni, F., Bellenger, J.-P., & Zhang, X. (2019). Molybdenum threshold for ecosystem scale alternative vanadium nitrogenase activity in boreal forests. Proceedings of the National Academy of Sciences, 116(49). https://doi.org/10.1073/pnas.1913314116
de Lajudie, P., & Young, J. P. W. (2020a). International committee on systematics of prokaryotes subcommittee on the taxonomy of rhizobia and agrobacteria minutes of the closed meeting by videoconference, 17 July 2019. International Journal of Systematic and Evolutionary Microbiology, 70(5), 3563–3571. https://doi.org/10.1099/IJSEM.0.004157/CITE/REFWORKS
de Lajudie, P., & Young, P. (2020b). International Committee on Systematics of Prokaryotes Subcommittee on the Taxonomy of Rhizobia and Agrobacteria Minutes of the closed meeting by videoconference, 17 July 2019 . International Journal of Systematic and Evolutionary Microbiology, 70, 3563–3571. https://doi.org/10.1099/ijsem.0.004157
Delfim, J., Schoebitz, M., Paulino, L., Hirzel, J., & Zagal, E. (2018). Phosphorus Availability in Wheat, in Volcanic Soils Inoculated with Phosphate-Solubilizing Bacillus thuringiensis. Sustainability, 10(2), 144. https://doi.org/10.3390/su10010144
Dreyfus, B., Garcia, J. L., & Gillis, M. (1988). Characterization of Azorhizobium caulinodans gen. nov., sp. nov., a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania rostrata. International Journal of Systematic Bacteriology, 38(1), 89–98. https://doi.org/10.1099/00207713-38-1-89/CITE/REFWORKS
Dubey, A., Malla, M. A., Khan, F., Chowdhary, K., Yadav, S., Kumar, A., Sharma, S., Khare, P. K., & Khan, M. L. (2019). Soil microbiome: a key player for conservation of soil health under changing climate. Biodiversity and Conservation, 28(8–9). https://doi.org/10.1007/s10531-019-01760-5
Egelhoff, T. T., & Long, S. R. (1985). Rhizobium meliloti nodulation genes: identification of nodDABC gene products, purification of nodA protein, and expression of nodA in Rhizobium meliloti. Journal of Bacteriology, 164(2), 591–599.
Espinoza, J. (n.d.). Fijación de fósforo en suelos derivados de ceniza volcánica. INFOBOS.
Ferrera-Cerrato, R. (2007). Microbiología Agrícola: Hongos, bacterias micro y macrofauna, control biológico y planta-microorganismo (1ra ed., Issue Sirsi) i9789682478109). México Editorial Trillas.
Fierer, N. (2017). Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Reviews Microbiology, 15(10). https://doi.org/10.1038/nrmicro.2017.87
Foo, E., McAdam, E. L., Weller, J. L., & Reid, J. B. (2016). Interactions between ethylene, gibberellins, and brassinosteroids in the development of rhizobial and mycorrhizal symbioses of pea. Journal of Experimental Botany, 67(8), 2413–2424. https://doi.org/10.1093/jxb/erw047
Garrity, G. (2007). Bergey’s Manual® of Systematic Bacteriology: Volume 2: The Proteobacteria, Part B: The Gammaproteobacteria. Springer Science & Business Media.
Gauthier-Coles, C., White, R. G., & Mathesius, U. (2019). Nodulating legumes are distinguished by a sensitivity to cytokinin in the root cortex leading to pseudonodule development. Frontiers in Plant Science, 9, 1–14. https://doi.org/10.3389/fpls.2018.01901
Giller, K. E., & Cadisch, G. (1995). Future benefits from biological nitrogen fixation: An ecological approach to agriculture. Plant and Soil, 174, 255–277.
Gough, C. (2003). Rhizobium Symbiosis: Insight into Nod Factor Receptors. Current Biology, 13(24), 973–975. https://doi.org/10.1016/j.cub.2003.11.047
Gupta, V. V. S. R., Zhang, B., Penton, C. R., Yu, J., & Tiedje, J. M. (2019). Diazotroph Diversity and Nitrogen Fixation in Summer Active Perennial Grasses in a Mediterranean Region Agricultural Soil. Frontiers in Molecular Biosciences, 6. https://doi.org/10.3389/fmolb.2019.00115
Heichel, G. H., Barnes, D. K., & Vance, C. P. (1981). Nitrogen Fixation of Alfalfa in the Seeding Year. Crop Science, 21(2), 330–335.
Herridge, D. F. (2008). Chapter 4: Inoculation Technology for Legumes. In M.J. Dilworth et al. (Ed.), Nitrogen-fixing Leguminous Symbioses (pp. 77–115). Springer Science+Business Media B.V,.
Hoffman, B. M., Lukoyanov, D., Yang, Z.-Y., Dean, D. R., & Seefeldt, L. C. (2014). Mechanism of Nitrogen Fixation by Nitrogenase: The Next Stage. Chemical Reviews, 114(8). https://doi.org/10.1021/cr400641x
Jaiswal, S. K., Mohammed, M., Ibny, F. Y. I., & Dakora, F. D. (2021). Rhizobia as a Source of Plant Growth-Promoting Molecules: Potential Applications and Possible Operational Mechanisms. Frontiers in Sustainable Food Systems, 4(1), 1–14. https://doi.org/10.3389/fsufs.2020.619676
Jorquera, M. A., Hernández, M. T., Rengel, Z., Marschner, P., & de la Luz Mora, M. (2008). Isolation of culturable phosphobacteria with both phytate-mineralization and phosphate-solubilization activity from the rhizosphere of plants grown in a volcanic soil. Biology and Fertility of Soils, 44(8), 1025–1034. https://doi.org/10.1007/s00374-008-0288-0
Khan, D., Peoples, M. B., & Herridge, D. F. (2002). 3 NSW Agriculture, Tamworth Centre for Crop Improvement. Plant and Soil, 245(4), 327–334.
Kneip, C., Lockhart, P., Voß, C., & Maier, U.-G. (2007). Nitrogen fixation in eukaryotes – New models for symbiosis. BMC Evolutionary Biology, 7(1), 1–12. https://doi.org/10.1186/1471-2148-7-55
Köberl, M., Wagner, P., Müller, H., Matzer, R., Unterfrauner, H., Cernava, T., & Berg, G. (2020). Unraveling the Complexity of Soil Microbiomes in a Large-Scale Study Subjected to Different Agricultural Management in Styria. Frontiers in Microbiology, 11. https://doi.org/10.3389/fmicb.2020.01052
Kuypers, M. M. M., Marchant, H. K., & Kartal, B. (2018). The microbial nitrogen-cycling network. Nature Reviews Microbiology, 16(5). https://doi.org/10.1038/nrmicro.2018.9
Kuzmanović, N., Biondi, E., Overmann, J., Puławska, J., Verbarg, S., Smalla, K., & Lassalle, F. (2020). Revisiting the taxonomy of Allorhizobium vitis (i.e. Agrobacterium vitis) using genomics – emended description of All. vitis sensu stricto and description of Allorhizobium ampelinum sp. nov. BioRxiv, 2020.12.19.423612. https://doi.org/10.1101/2020.12.19.423612
Lei, S., Pulakat, L., & Gavini, N. (2000). Activation of vanadium nitrogenase expression in Azotobacter vinelandii DJ54 revertant in the presence of molybdenum. FEBS Letters, 482(1–2). https://doi.org/10.1016/S0014-5793(00)02052-4
Li, X., Jousset, A., de Boer, W., Carrión, V. J., Zhang, T., Wang, X., & Kuramae, E. E. (2019). Legacy of land use history determines reprogramming of plant physiology by soil microbiome. The ISME Journal, 13(3). https://doi.org/10.1038/s41396-018-0300-0
Lindström, K., & Mousavi, S. A. (2020). Effectiveness of nitrogen fixation in rhizobia. Microbial Biotechnology, 13(5). https://doi.org/10.1111/1751-7915.13517
Liu, C.-W., & Murray, J. (2016). The Role of Flavonoids in Nodulation Host-Range Specificity: An Update. Plants, 5(33), 1–13. https://doi.org/10.3390/plants5030033
Mahmud, K., Makaju, S., Ibrahim, R., & Missaoui, A. (2020). Current Progress in Nitrogen Fixing Plants and Microbiome Research. Plants, 9(1), 1–17. https://doi.org/10.3390/plants9010097
Maróti, G., & Kondorosi, E. (2014). Nitrogen-fixing Rhizobium-legume symbiosis: are polyploidy and host peptide-governed symbiont differentiation general principles of endosymbiosis? Frontiers in Microbiology, 5. https://doi.org/10.3389/fmicb.2014.00326
Masson-Boivin, C., Giraud, E., Perret, X., & Batut, J. (2009). Establishing nitrogen-fixing symbiosis with legumes: how many rhizobium recipes? Trends in Microbiology, 17(10). https://doi.org/10.1016/j.tim.2009.07.004
Mayer, J., Buegger, F., Steen Jensen, E., Schloter, M., & Heß, J. (2003). Estimating N rhizodeposition of grain legumes using a 15 N in situ stem labelling method. Soil Biology & Biochemistry, 35, 21–28.
McGuiness, P. N., Reid, J. B., & Foo, E. (2019). The role of gibberellins and brassinosteroids in nodulation and arbuscular mycorrhizal associations. In Frontiers in Plant Science (Vol. 10, pp. 1–7). Frontiers Media S.A. https://doi.org/10.3389/fpls.2019.00269
Morales, A., Alvear, M., Valenzuela, E., Rubio, R., & Borie, F. (2007). Effect of inoculation withPenicillium albidum, a phosphate-solubilizing fungus, on the growth ofTrifolium pratense cropped in a volcanic soil. Journal of Basic Microbiology, 47(3), 275–280. https://doi.org/10.1002/jobm.200610255
Mousavi, S. A., Österman, J., Wahlberg, N., Nesme, X., Lavire, C., Vial, L., Paulin, L., de Lajudie, P., & Lindström, K. (2014). Phylogeny of the Rhizobium–Allorhizobium–Agrobacterium clade supports the delineation of Neorhizobium gen. nov. Systematic and Applied Microbiology, 37(3), 208–215. https://doi.org/10.1016/J.SYAPM.2013.12.007
Mus, F., Crook, M. B., Garcia, K., Garcia Costas, A., Geddes, B. A., Kouri, E. D., Paramasivan, P., Ryu, M.-H., Oldroyd, G. E. D., Poole, P. S., Udvardi, M. K., Voigt, C. A., Ané, J.-M., & Peters, J. W. (2016). Symbiotic Nitrogen Fixation and the Challenges to Its Extension to Nonlegumes. Applied and Environmental Microbiology, 82(13). https://doi.org/10.1128/AEM.01055-16
Nag, P., Shriti, S., & Das, S. (2020). Microbiological strategies for enhancing biological nitrogen fixation in nonlegumes. Journal of Applied Microbiology, 129(2). https://doi.org/10.1111/jam.14557
Pankievicz, V. C. S., Irving, T. B., Maia, L. G. S., & Ané, J.-M. (2019). Are we there yet? The long walk towards the development of efficient symbiotic associations between nitrogen-fixing bacteria and non-leguminous crops. BMC Biology, 17(1). https://doi.org/10.1186/s12915-019-0710-0
Patiño-Torres, C., & Sanclemente-Reyes, O. (2014). Los microorganismos solubilizadores de fósforo (MSF): una alternativa biotecnológica para una agricultura sostenible. Entramado, 10(2), 288–297.
Peng, T., Xu, Y., & Zhang, Y. (2018). Comparative genomics of molybdenum utilization in prokaryotes and eukaryotes. BMC Genomics, 19(1). https://doi.org/10.1186/s12864-018-5068-0
Phour, M., Sehrawat, A., Sindhu, S. S., & Glick, B. R. (2020). Interkingdom signaling in plant-rhizomicrobiome interactions for sustainable agriculture. Microbiological Research, 241. https://doi.org/10.1016/j.micres.2020.126589
Poole, P., Ramachandran, V., & Terpolilli, J. (2018). Rhizobia: from saprophytes to endosymbionts. Nature Reviews Microbiology, 16(5). https://doi.org/10.1038/nrmicro.2017.171
Ramírez-Puebla, S. T., Hernández, M. A. R., Guerrero Ruiz, G., Ormeño-Orrillo, E., Martinez-Romero, J. C., Servín-Garcidueñas, L. E., Núñez-de la Mora, A., Amescua-Villela, G., Negrete-Yankelevich, S., & Martínez-Romero, E. (2019). Nodule bacteria from the cultured legume Phaseolus dumosus (belonging to the Phaseolus vulgaris cross-inoculation group)with common tropici phenotypic characteristics and symbiovar but distinctive phylogenomic position and chromid. Systematic and Applied Microbiology, 42(3), 373–382. https://doi.org/10.1016/J.SYAPM.2018.12.007
Ramos-Hernández, S., & Flores-Román, D. (2008). Comparación de dos fuentes fosfatadas en suelos volcánicos cultivados con café del soconusco, Chiapas, México. Agrociencia, 42(4), 391–398.
Rawat, P., Das, S., Shankhdhar, D., & Shankhdhar, S. C. (2021). Phosphate-Solubilizing Microorganisms: Mechanism and Their Role in Phosphate Solubilization and Uptake. Journal of Soil Science and Plant Nutrition, 21(1), 49–68. https://doi.org/10.1007/s42729-020-00342-7
Rivas, R., Willems, A., Palomo, J. L., García-Benavides, P., Mateos, P. F., Martínez-Molina, E., Gillis, M., & Velázquez, E. (2004). Bradyrhizobium betae sp. nov., isolated from roots of Beta vulgaris affected by tumour-like deformations. International Journal of Systematic and Evolutionary Microbiology, 54(4), 1271–1275. https://doi.org/10.1099/IJS.0.02971-0/CITE/REFWORKS
Rivas, R., Willems, A., Subba-Rao, N. S., Mateos, P. F., Dazzo, F. B., Kroppenstedt, R. M., Martínez-Molina, E., Gillis, M., & Velázquez, E. (2003). Description of Devosia neptuniae sp. nov. that nodulates and fixes nitrogen in symbiosis with Neptunia natans, an aquatic legume from India. Systematic and Applied Microbiology, 26(1), 47–53. https://doi.org/10.1078/072320203322337308
Schwember, A. R., Schulze, J., del Pozo, A., & Cabeza, R. A. (2019). Regulation of Symbiotic Nitrogen Fixation in Legume Root Nodules. Plants, 8(9). https://doi.org/10.3390/plants8090333
Shamseldin, A., Abdelkhalek, A., & Sadowsky, M. J. (2017). Recent changes to the classification of symbiotic, nitrogen-fixing, legume-associating bacteria: a review. Symbiosis, 71(2), 91–109. https://doi.org/10.1007/s13199-016-0462-3
Silva, L., Pereira, M., Carvalho, A., Buttrós, V., Pasqual, M., & Dória, J. (2023). Phosphorus-Solubilizing Microorganisms: A Key to Sustainable Agriculture. Agriculture, 13(2), 462.
Srinivasan, R., Yandigeri, M. S., Kashyap, S., & Alagawadi, A. R. (2012). Effect of salt on survival and P-solubilization potential of phosphate solubilizing microorganisms from salt affected soils. Saudi Journal of Biological Sciences, 19(4), 427–434. https://doi.org/10.1016/j.sjbs.2012.05.004
Stajković, O., Delić, D., Jošić, D., Kuzmanović, Đ., Rasulić, N., & Knežević-Vukčević, J. (2011). Improvement of common bean growth by co-inoculation with Rhizobium and plant growth-promoting bacteria. Romanian Biotechnological Letters, 16(1), 5919–5926.
Sy, A., Giraud, E., Jourand, P., Garcia, N., Willems, A., De Lajudie, P., Prin, Y., Neyra, M., Gillis, M., Boivin-Masson, C., & Dreyfus, B. (2001). Methylotrophic Methylobacterium bacteria nodulate and fix nitrogen in symbiosis with legumes. Journal of Bacteriology, 183(1), 214–220. https://doi.org/10.1128/JB.183.1.214-220.2001
Sylvia, D. M., Furhrmann, J. J., Hartel, P. G., & Zuberer, D. A. (1999). Principles and applications of soil microbiology. Prentice-Hall.
Ta, T. C., & Faris, M. A. (1988). Effects of environmental conditions on the fixation and transfer of nitrogen from alfalfa to associated timothy. Plant and Soil, 107, 25–30.
Tajini, F., Trabelsi, M., & Drevon, J.-J. (2012). Combined inoculation with Glomus intraradices and Rhizobium tropici CIAT899 increases phosphorus use efficiency for symbiotic nitrogen fixation in common bean (Phaseolus vulgaris L.). Saudi Journal of Biological Sciences, 19(2), 157–163. https://doi.org/10.1016/j.sjbs.2011.11.003
Tao, W., Martínez, J., & López, I. (2004). Rhizobium y su destacada simbiosis con plantas. Microbios, 1.
Tian, Q., Taniguchi, T., Shi, W.-Y., Li, G., Yamanaka, N., & Du, S. (2017). Land-use types and soil chemical properties influence soil microbial communities in the semiarid Loess Plateau region in China. Scientific Reports, 7(1). https://doi.org/10.1038/srep45289
van Sambeek, J. W., & Garrett, H. E. (2004). Ground cover management in walnut and other hardwood plantings. In C. H. Michler, P. M. Pijut, J. W. van Sambeek, M. V. Coggeshall, J. Seifert, K. Woeste, R. Overton, & F. Ponder (Eds.), Proceedings of the 6th Walnut Council Research Symposium (Vol. 188, pp. 188-). U.S. Department of Agriculture, Forest Service, North Central Research Station.
Vandammel, P., Goris, J., Chen, W. M., de Vos, P., & Willems, A. (2002). Burkholderia tuberum sp. nov. and Burkholderia phymatum sp. nov., nodulate the roots of tropical legumes. Systematic and Applied Microbiology, 25(4), 507–512. https://doi.org/10.1078/07232020260517634
Vaneechoutte, M., Kämpfer, P., de Baere, T., Falsen, E., & Verschraegen, G. (2004). Wautersia gen. nov., a novel genus accommodating the phylogenetic lineage including Ralstonia eutropha and related species, and proposal of Ralstonia [Pseudomonas] syzygii (Roberts et al. 1990) comb. nov. International Journal of Systematic and Evolutionary Microbiology, 54(Pt 2), 317–327. https://doi.org/10.1099/IJS.0.02754-0
Walker, L., Lagunas, B., & Gifford, M. L. (2020). Determinants of Host Range Specificity in Legume-Rhizobia Symbiosis. Frontiers in Microbiology, 11. https://doi.org/10.3389/fmicb.2020.585749
Wang, Q., Liu, J., & Zhu, H. (2018). Genetic and Molecular Mechanisms Underlying Symbiotic Specificity in Legume-Rhizobium Interactions. Frontiers in Plant Science, 9. https://doi.org/10.3389/fpls.2018.00313
Wang, W., & Zhu, W. (2012). Soil retention of 15N in a simulated N deposition study: effects of live plant and soil organic matter content. Plant and Soil, 351(1–2), 61–72.
Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., & Sawada, H. (2001). A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. International Journal of Systematic and Evolutionary Microbiology, 51(Pt 1), 89–103. https://doi.org/10.1099/00207713-51-1-89
Zakhia, F., & Lajudie, P. De. (2006). Modern bacterial taxonomy: techniques review–application to bacteria that nodulate leguminous plants (BNL). Canadian Journal of Microbiology, 52(3), 169–181.
Zehr, J. P., Jenkins, B. D., Short, S. M., & Steward, G. F. (2003). Nitrogenase gene diversity and microbial community structure: a cross-system comparison. Environmental Microbiology, 5(7). https://doi.org/10.1046/j.1462-2920.2003.00451.x
Zhang, X., Chen, Q., & Han, X. (2013). Soil Bacterial Communities Respond to Mowing and Nutrient Addition in a Steppe Ecosystem. PLoS ONE, 8(12). https://doi.org/10.1371/journal.pone.0084210
Zhang, X., Fang, Q., Zhang, T., Ma, W., Velthof, G. L., Hou, Y., Oenema, O., & Zhang, F. (2020). Benefits and trade‐offs of replacing synthetic fertilizers by animal manures in crop production in China: A meta‐analysis. Global Change Biology, 26(2). https://doi.org/10.1111/gcb.14826
Zheng, Q., Hu, Y., Zhang, S., Noll, L., Böckle, T., Dietrich, M., Herbold, C. W., Eichorst, S. A., Woebken, D., Richter, A., & Wanek, W. (2019). Soil multifunctionality is affected by the soil environment and by microbial community composition and diversity. Soil Biology and Biochemistry, 136. https://doi.org/10.1016/j.soilbio.2019.107521
Zúñiga, A., Poupin, M. J., Donoso, R., Ledger, T., Guiliani, N., Gutiérrez, R. A., & González, B. (2013). Quorum sensing and indole-3-acetic acid degradation play a role in colonization and plant growth promotion of arabidopsis thaliana by burkholderia phytofirmans PsJN. Molecular Plant-Microbe Interactions, 26(5), 546–553. https://doi.org/10.1094/MPMI-10-12-0241-R
Zúñiga, F., Buenaño, M., & Risco, D. (2016). Caracterización física y química de suelos de origen volcánico con actividad agrícola, próximos al volcán Tungurahua. Revista Ecuatoriana de Investigaciones Agropecuarias, 1, 5–10.
Recomendación
¿Sabías que la falsa autoría en la ciencia no solo roba méritos, sino que frena el progreso de la humanidad? Te invitamos a profundizar en este tema con nuestro ensayo: ‘El costo social de la falsa autoría en la ciencia’, donde exploramos cómo este fenómeno erosiona la confianza en el conocimiento y afecta a toda la sociedad. ¡Una lectura imprescindible para entender los desafíos de la ciencia actual!

¿Te gustaría conocer más sobre cómo impulsamos la innovación y el conocimiento desde Eñengi? Visita nuestra página y descubre cómo estamos transformando el futuro a través del e-learning. ¡Haz clic aquí y únete a nuestra comunidad de cambio!







Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.