Tabla de Contenidos
Introducción
El fréjol (Phaseolus vulgaris L.) es una dicotiledónea perteneciente a la familia de las leguminosas, conocido también como frijol, poroto, judía o habichuela. Es un cultivo con gran importancia económica, ecológica y social (Morales, 2015). Esta leguminosa es uno los granos alimenticios más consumidos, debido a que posee grasas, que son una gran fuente de proteínas, carbohidratos y fibras, además, de contener vitaminas del complejo B (niacina, riboflavina, ácido fólico y tiamina) y minerales, como potasio, zinc, magnesio y hierro (Ulloa et al., 2011; Peralta et al., 2010).
En Ecuador, según Peralta et al. (2013) las leguminosas son componentes de los sistemas de producción, especialmente en la región Sierra. El área aproximada de cultivo de fréjol en Ecuador es de 225000 ha, con un porcentaje del 84% destinado para el grano seco y lo restante es para el consumo del grano tierno. Las provincias con una mayor producción de fréjol son: Imbabura (17 %), Azuay (15 %), Loja (14 %), Chimborazo (11 %), Carchi (9.5 %), esto dentro de la región Sierra, mientras que en la región Costa están el Guayas (7.7 %) y Los Ríos (2.6 %), por último y no menos importante esta la Amazonia con un 2 % de producción en toda la región (Morales, 2015).
Según Núñez & Cruz (2015) el fréjol tiene la capacidad de fijar el nitrógeno atmosférico, por lo que juega un papel importante dentro de la agricultura, debido a que contribuye a la disminución del consumo de energía fósil y a la emisión de gases de efecto invernadero, producidos por el uso de fertilizantes. Escalante et al. (2000) demostró que con la fertilización nitrogenada puede lograrse incrementar el rendimiento del fréjol. Además, según Morales (2015) el Ecuador es un país eminentemente agrícola, donde el sector primario de la economía (agricultura, silvicultura, caza y pesca) encargado de proveer de alimentos a la sociedad.
La cantidad de nitrógeno fijado por una leguminosa depende no sólo de la calidad de la cepa bacteriana presente, sino también de las condiciones externas (Navarro, 2003). Pese a que la información es escasa, se debe acudir a la práctica para determinar los efectos del nitrógeno en el suelo, por lo que, un abastecimiento adecuado de nitrógeno favorece a un desarrollo vigoroso y a la producción de proteínas. Sin embargo, un aporte excesivo de nitrógeno puede provocar un desarrollo vegetativo anormal, reducción de la floración y un retraso en la maduración (Cedano et al., 2000).
Objetivos
Objetivo General
Implementar en el Campo Docente Experimental “La Tola” una parcela demostrativa de manejo integral del cultivo de fréjol arbustivo (Phaseolus vulgaris L.) variedad Campeón a través del cual se integren los conocimientos de las siete asignaturas del quinto semestre de carrera de Agronomía.
Objetivos específicos
Determinar variables agronómicas según las etapas fenológicas del cultivo de fréjol arbustivo para su manejo integral en las condiciones de estudio del CADET.
Conocer la ploidía que poseen los diferentes genotipos de fréjol.
Determinar el grupo de ploidía al que pertenece el genotipo seleccionado.
Determinar las necesidades nutricionales y de riego de fréjol arbustivo, en las condiciones de estudio.
Determinar variables fitosanitarias según las etapas fenológicas del cultivo de fréjol arbustivo y el manejo sostenible de los artrópodos y microorganismos plaga encontrados.
Determinar la uniformidad de distribución del agua, pluviometría y la uniformidad de humedecimiento del suelo.
Marco Teórico
Producción de fréjol
Mundial
La productividad de este cultivo engloba distintas áreas, cultivándose en casi todo el mundo, Latinoamérica resalta como la región que más consume y produce este cultivo, más del 45 % de lo producido mundialmente procede de esta parte del mundo (Calero et al., 2018). Sin embargo, se estima un aproximado de 29 millones de hectáreas de cultivo de frijol en el mundo, produciéndose anualmente 22,8 millones de toneladas de este cultivar seco, sobresale Asia como la mayor productora (44,8 %), América (35,1 %) y África (17,3 %) (Gómez, 2019).
Ecuador
En Ecuador para este cultivo transitorio se estima una siembra aproximada de 103.377 ha de fréjol y 0.58 t ha-1 respecto al promedio de rendimiento del cultivo (MAGAP, 2005). Según el SIPA, en sus cifras agroproductivas de los principales cultivos del Ecuador la producción de fréjol en grano seco para el año 2020 fue de 11,873 toneladas y a nivel provincial en Pichincha la producción estimada para el año 2020 fue de 49 toneladas de grano seco de fréjol.
Cultivo de fréjol (Cultivos)
El fréjol o fríjol es una especie que presenta gran variabilidad genética, existiendo miles de cultivares que producen grano de los más diversos colores, formas y tamaños (Morales, 2015). Más conocida del género Phaseolus en la familia Fabaceae con unas cincuenta especies de plantas, todas nativas de América (Sánchez et al., 2013). Actualmente se encuentra distribuido en los cinco continentes y es un componente esencial de la dieta, especialmente en Centroamérica y Sudamérica (Ulloa et al., 2011).
Descripción
La variedad de frejol Campeón al ser producida por pequeños productores no deriva de algún cruce genético, físicamente denota un color rojo moteado con blanco en su estructura de forma cilíndrica, según la literatura posee buen rendimiento y se ha adaptado a distintas zonas entre ellas Tumbaco, Urcuquí y Cotacachi (Velasco, 2020).
Taxonomía
| Reino: | Plantae |
| Subreino: | Viridaeplantae |
| División: | Tracheophyta |
| Subdivisión: | Spermatophytina |
| Infradivisión: | Angiospermae |
| Clase: | Magnoliopsida |
| Superorden: | Rosanae |
| Orden: | Fabales |
| Familia: | Fabaceae |
| Género: | Phaseolus |
| Especie: | Phaseolus vulgaris |
Genética de la variedad (Genética)
Observación de los cromosomas
Los cromosomas son estructuras complejas ubicadas en el núcleo de las células, compuestos por DNA, histonas y otras proteínas, RNA y polisacáridos, son básicamente los «paquetes» que contienen el DNA. Normalmente los cromosomas no se pueden ver con un microscopio óptico, pero durante la división celular se condensan lo suficiente como para poderse analizar fácilmente a 1.000 aumentos.
Para obtener células con sus cromosomas en este estado condensado, se las expone a un inhibidor de la mitosis, que bloquea la formación del huso mitótico y detiene la división celular en la etapa de metafase. Prácticamente todos los análisis citogenéticos de rutina se realizan sobre preparaciones cromosómicas que se han tratado y teñido para producir un patrón de bandas específico de cada cromosoma. Esto permite la detección de cambios sutiles en la estructura de los cromosomas. El tratamiento de tinción más común se llama bandeo G (Mudry, 2014).
Preparación citogenética de meristemas de raíz y hojas jóvenes
Los primeros citólogos desarrollaron métodos basados principalmente en el uso de la parafina y el corte al micrómetro de secciones finas de la punta de la raíz para la observación de cromosomas bajo el microscopio óptico. Esta metodología dio buenos resultados en su tiempo, hasta la aparición de la técnica del aplastado de puntas de raíz conocido como “squash” que consiste en un número de pasos a seguir desde la obtención de raíces, hasta la observación de los cromosomas bajo el microscopio óptico (Valladolid, Blas, & Gonzáles, 2004).
Origen de los organismos poliploides.
La poliploidía es el incremento del tamaño del genoma causado por la presencia de tres o más juegos de cromosomas, estos organismos fueron descubiertos accidentalmente por el hombre mientras este seleccionaba especímenes de cereales y otras plantas de cosecha o de frutos grandes, desde ese momento los cultivos poliploides han generado mayor rendimiento, por hectárea, ausencia de semillas, mayor tamaño (Otto & Whitton, 2000).
La poliploidía se puede dar por una falla en la división reduccional de la meiosis durante la primera división (asociado con procesos que se llevan a cabo en la profase I, como el entrecruzamiento entre cromátidas). También puede surgir a través de la polispermia o de la hibridación interespecífica entre especies, (se debe a que los híbridos diploides tienen altas tasas de formación de gametos no reducidos). Otra forma en la que se produce es por la llamada “duplicación somática” (las regiones meristemáticas de la planta, en las cuales se lleva a cabo el crecimiento, pueden entrar en la profase con el número de cromosomas duplicados sin tener un anafase normal (Alcántar, 2014).
De igual forma Comai (2005) menciona que el origen de los poliploides se da por la producción de gametos no reducidos o por la duplicación somática en el caso de las plantas.
Citogenética.
La citogenética es la disciplina que estudia las implicaciones genéticas de la estructura y el comportamiento del cromosoma, con las nuevas técnicas destinadas al análisis de cromosomas, tanto mitóticos como meióticos han abierto la posibilidad de estudiar regiones específicas de la cromatina directamente sobre los cromosomas (Herrera, 2007). El frejol y otras especies del género Phaseolus son organismos diploides con 11 cromosomas (2n = 2X= 22 cromosomas) Los cuales son extremadamente pequeños y de similar morfología (Broughton et al., 2003).
División celular
La división celular es una gran parte del ciclo celular que se está dividiendo para formar la celda de una niña. El desarrollo de la existencia de la vida ocurre debido a la división celular. En criaturas multicelulares, este crecimiento se produce debido al desarrollo del tejido al ignorar la regeneración y los unicelulares (Angel & Angón, 2015)
Los organismos multicelulares reemplazan su complemento celular a través de la división celular, que a menudo se asocia con la diferenciación celular. En algunos animales, la división celular se detiene en algún momento y las células finalmente envejecen. Debido al proceso de envejecimiento del cuerpo, las células falciformes degeneran y mueren. Las células dejan de dividirse porque los telómeros se acortan con cada división y no pueden proteger a los cromosomas por sí mismos (Cidead, 2011)
Los inhibidores del huso acromático
Los inhibidores del huso acromático son frecuentemente usados para el tratamiento anticáncer y los inhibidores de KSP/Eg5, Plk1 y Auroras quinasas están actualmente en el desarrollo clínico. La interferencia con el huso mitótico resulta en prometafase, mientras que la inhibición de KSP/Eg5, Plk1 y Aur-A generan un fenotipo de arresto mitótico con husos monopolares predominantes (Gagneten et al., 2015).
Inhibición de Aurora-B previene la citocinesis e induce poliploidías. En el tratamiento prolongado con venenos del huso e inhibidores de quinesinas, las células exhiben un desprendimiento mitótico con la inducción subsecuente de apoptosis en la fase G1 (Bendaña, 2015). Hasta ahora, no está claro si las células tratadas con los inhibidores de la Aur-A o de Plk1 sufren apoptosis durante el arresto mitótico o si ocurre el desprendimiento mitótico. Significativamente, es evidente que las quinesinas mitóticas son dianas efectivas de las drogas que pueden ser inhibidores competitivos o alostéricos (Rodríguez & Frias, 2015).
Observación de los cromosomas
Los cromosomas son estructuras complejas ubicadas en el núcleo de las células, compuestos por DNA, histonas y otras proteínas, RNA y polisacáridos. Son básicamente los «paquetes» que contienen el DNA. Normalmente los cromosomas no se pueden ver con un microscopio óptico, pero durante la división celular se condensan lo suficiente como para poderse analizar fácilmente a 1.000 aumentos.
Para obtener células con sus cromosomas en este estado condensado, se las expone a un inhibidor de la mitosis, que bloquea la formación del huso mitótico y detiene la división celular en la etapa de metafase. Prácticamente todos los análisis citogenéticos de rutina se realizan sobre preparaciones cromosómicas que se han tratado y teñido para producir un patrón de bandas específico de cada cromosoma. Esto permite la detección de cambios sutiles en la estructura de los cromosomas. El tratamiento de tinción más común se llama bandeo G (Mudry, 2014).
Preparación citogenética de meristemas de raíz y hojas jóvenes
Los primeros citólogos desarrollaron métodos basados principalmente en el uso de la parafina y el corte al micrómetro de secciones finas de la punta de la raíz para la observación de cromosomas bajo el microscopio óptico. Esta metodología dio buenos resultados en su tiempo, hasta la aparición de la técnica del aplastado de puntas de raíz conocido como “squash” que consiste en un número de pasos a seguir desde la obtención de raíces, hasta la observación de los cromosomas bajo el microscopio óptico Después del proceso de coloración, el “squash” convencional se realizó entre el porta y el cubreobjetos, para así dispersarlos y al hacerse visible se encontraron en un mismo plano (Valladolid, Blas, & Gonzáles, 2004).
Tecnicas para el análisis citogenético
Las técnicas para el análisis citogenético son metodologías diseñadas para el estudio de número, morfología y comportamiento de cromosomas (Escobar, 2016).
Citometría de flujo
Esta técnica posibilita la caracterización de poblaciones celulares heterogéneas por medio de un extenso rango de propiedades biológicas, este método analítico posibilita la medición de emisión de fluorescencia y dispersión de luz, incitadas por la luminosidad propicia de célula o partícula microscópica mientras se trasladan una por una y llevadas por un flujo portador hacia un sistema de detección, pues aprovecha el avance de un extenso número de moléculas fluorescentes que van uniéndose precisamente a moléculas celulares, que modificaran sus propiedades o serán acumuladas en compartimentos, permitiendo así la detección y cuantificación de estructura y función de células individuales o partículas biológicas aisladas a muy alta velocidad siguiendo una aproximación multiparamétrica (Gutiérrez y Moreno, 2005).
Determinación del cariotipo
Los estudios del cariotipo se fundamentan en especificar a los cromosomas según sus caracteres morfológicos, como ubicación del centrómero, proporción del cromosoma y de los brazos, considerando estos aspectos se establece el numero así, cromosoma mayor es uno y posteriormente hasta el pequeño siendo el último número (Rodríguez, 1995).
Bandeo cromosómico
Esta técnica de análisis citogenético visualiza las distintas segmentaciones o bandas de cromosomas que son observables bajo microscopio por tinción con químicos, es utilizado al reconocer y designar donde se ubica el gen en un cromosoma y si presenta alteraciones (Drets, 2002), se mencionan los siguientes bandeos.
Bandeo G (Giemsa-wright), visualiza regiones oscuras y claras donde predomina AT y GC respectivamente, generando un patrón específico sobre cada par cromosómico homologo.
Bandeo Q (Quinacrina), encuentra regiones fluorescentes y opacas con mayor predominio de AT y GC respectivamente, posibilita la formación de patrón de bandeo especifico en cada par cromosomico homólogo, facilitando visualizar por fluorescencia el cromosoma Y.
Bandeo C (Giemsa), se detecta regiones centroméricas y heterocromatina muy repetitivas del cromosoma Y, a partir de ácido y base fuertes
Técnicas con fluorescencia
-Hirbidacion fluorescente in situ (fish)
Este método permite la identificación de cromosomas o detección de segmentos cromosómicos utilizando sondas de secuencias cortas de ADN, con marcadores citogenéticos que se hibridan con una secuencia específica de cromosomas (Auteri et al., 2019)
-Hibridación genómica in situ (gish)
La hibridación genómica in situ GISH, es una técnica empelada en el mejoramiento genético de especies vegetales, misma que deriva de FISH, posibilita la identificación de grupos de cromosomas (Raina & Rani, 2001).
Nudos cromosómicos
Los nudos cromosómicos considerados marcador genético estable para sitio fijo en cromosomas para el género Zea, en esta técnica se observa el abultamiento de cromosomas de color oscuros, en un sitio especifico según grupo o raza pertenecientes, los nudos aparecen de cero a n en un único cromosoma, explican la convergencia y divergencia de la especie que los presentan (Sánchez, 2011).
Descripcion citogenetica del género phaseolus
Phaseolus vulgaris y demás especies del género Phaseolus, son diploides con 11 cromosomas (2n=2X=22 cromosomas), extremadamente pequeños y morfológicamente similares entre sí. Aquellos cromosomas de meiosis y mitosis miden cerca de 1 a 3 µm, son metacéntricos y submetacentricos, de entre los genomas más pequeños está el del fréjol, posee un mapa genético muy desarrollado y un vasto número de marcadores moleculares que entre más especies se relacionan estrechamente en sus genomas (Londoño, 2011).
Requerimientos del Cultivo
García (2009), menciona que los suelos más adecuados para la producción de fréjol son los francos arcillosos y los francos arenosos con pH que oscila entre 5,5 a 7,0. Estos tipos de suelos permiten una mejor aireación, necesario para el desarrollo de nódulos en las raíces y posibilita que estos absorban el aire de la atmósfera de forma más eficiente para la captación de nitrógeno libre y su adhesión a las plantas de fréjol, favoreciendo un incremento en la producción del cultivo.
Además, para la siembra de vainitas en terrenos con topografía plana o semi plana, se recomienda dos pases de arado en forma cruzada, uno de rastra, nivelado y surcado
Requerimiento hídrico
El fréjol arbustivo para un buen rendimiento necesita agua bien distribuida de 400 a 500 mm, mediante el riego o la influencia de la lluvia; en etapas del crecimiento de la planta en las que la humedad insuficiente afecta el rendimiento, incluida la germinación, la floración y la formación de frutos. En áreas como Babahoyo, Vinces, Milagro y Taura, se requiere riego cuando se siembra en la estación seca (Guamán et al., 2004).
González (2003) indica que el crecimiento óptimo de las plantas de fréjol ocurre a temperaturas de 10 a 27 °C, humedad relativa del aire de 70 a 80 %, altitudes de 200 a 1500 msnm y precipitaciones de 300 a 400 mm de lluvia.
Manejo del Suelo (Mecanización)
La mecanización agrícola es un instrumento de gestión de la agricultura, el cual aumentara los rendimientos de los cultivos. Además, reduce el trabajo humano ya que sale menos extenuante conducir un tractor que cultivar todo un campo con un azadón u otra herramienta manual (Cortés et al., 2009).
Para el proyecto antes de la siembra se utilizó un motocultor para preparar el suelo, este se pasó dos veces por el terreno tanto en forma horizontal como vertical, con el objetivo de remover la capa arable del suelo, proporcionando una mejor aireación a la vez que se va eliminando las malezas que en un futuro puedan competir con el cultivo.
El motocultor es considerado como un tractor de un solo eje que trabaja a una velocidad de 1 a 5 km/h, el cual se conduce a pie mediante unos brazos denominados manceras, a esta máquina se le pueden acoplar diferentes implementos agrícolas igual que a un tractor (MAPA, 2016). Su principal función es el trabajo del suelo, habitualmente realizada mediante azadas rotativas integradas en el apero, conocido como rotocultor (Márquez, 2012).
Esta maquinaria utiliza motores monocilíndricos refrigerados por aire, generalmente motores a diésel de cuatro tiempos, con potencias entre 10 y 20 CV, y una cilindrada entre 250 y algo más de 500 cm3, con un régimen de funcionamiento máximo entre 3000 y 3800 rev/min (BCS, 2009).
Medidas de protección
- El tren de azadas debe ir siempre con la cubierta integrada de protección.
- Se debe revisar constantemente el estado de conservación de la cubierta, y adoptar las medidas de mantenimiento oportunas que garanticen el estado de la misma.
- Todo motocultor debe disponer de un mecanismo automático de desembrague que desconecte la transmisión de toma de fuerza tan pronto como se conecte la marcha atrás, para que no permita el movimiento de la maquinaria hasta la total detención de las azadas.
(Navarra, 2014)
Medidas de prevención
- Toda persona que maneje el motocultor debe conocer perfectamente su funcionamiento.
- Como toda maquinaria agrícola es importante a ver leído el manual de instrucciones antes de manejarlo.
- Debe evitar dar marcha atrás con el motocultor mientras las azadas sigan girando.
- Bajo ninguna circunstancia el operario se subirá a la carcasa de protección.
- Bajo ninguna circunstancia se soltarán las manceras del motocultor.
- En caso de atasco, se deberá desconectar la toma de fuerza del tren de azadas hasta que se detenga por completo, desatascar la maquinaria y se puede volver al trabajo.
(Navarra, 2014)
Plagas y Enfermedades (Fitopatología Aplicada y Entomología Aplicada)
Plagas entomológicas
Gusanos trozadores y tierreros, Agrotis sp. (Lepidóptera – Noctuidae); Spodoptera spp. (Lepidoptera – Noctuidae); Feltia subterránea (Lepidoptera – Noctuidae)
Son grupos de insectos que en estado larvario atacan impredeciblemente a los tallos de plántulas de frijol a la altura del cullo de las raíces en la parte subterránea cortándolos o destrozándolos, algunos insectos como el género Feltia sp. Se alimenta de la epidermis de las hojas y las vainas al igual que el género Spodoptera sp que se alimenta de vainas y hojas en plantas pequeñas, su ataque es de importancia económica debido a que una infestación alta de gusanos cortadores puede causar el 80% de reducción en la población de plantas de frijol y además los daños permiten la entrada de hongos como Fusarium sp., Phythium sp. y Rhyzoctonia sp (González, Salguero, & Mancía, 1992).
Minador de la hoja, Epinotia sp (Lepidoptera – Tortricidae)
Esta especie de insecto causa daños en su estado larvario, cuando so recién nacidos su hábito alimenticio es consumir las partes tiernas de la planta, posteriormente perfora los tallos y vainas, estos órganos se pudren debido a la presencia de hongos ocasionados por la introducción del insecto, este insecto tiene su etapa crítica en plena floración y etapa de formación de vainas (Urbina, 2018).
Defoliador de la hoja, Trichoplusia sp. (Lepidoptera – Noctuidae)
Es causado especialmente por el estado larvario de este insecto pues estos perforan las hojas y vainas desde los bordes hacia la nervadura central. Las altas poblaciones de este insecto, aproximadamente cuando la planta es defoliada en un 30% es considerado importante pues una vez pasado este umbral el cultivo reduce su rendimiento (Aguado, Sánchez, Rubiano, & Sierra, 2020)
Áfidos del frijol Myzus sp. (hemiptera – Aphididae) y Aphis sp (hemiptera – Aphididae)
Estas especies afecta a una gran gama de cultivos causan daño a través de sus estados adulto y ninfa los cuales se alimentan de la sabia de los tejidos tiernos como yemas y hojas nuevas (Corrales, Villalobos, Vargas, Rodríguez, & Gonzáles, 2017), son una plaga primaria de importancia económica pues son capaces de transmitir virus a las plantas causando de esta manera debilitamiento, marchitez, enrollamiento de hojas y su creciente poblacional puede producir la propagación de hongos fitopatógenos, este crecimiento y localización incide dependiendo de las fases fenológicas tempranas y diferentes temperaturas (Taibo & Ramos, 2020).
Lorito verde, Empoasca kraemen (Hemiptera – Cicadellidae).
El lorito verde es una plaga la cual se hace presente durante todo el ciclo vegetal del frijol, su daño es causado por las ninfas y los estados adultos al momento de su alimentación en las hojas, su tipo de alimentación succionadora de sabia ocasiona que se presente en las hojas clorosis y necrosis reduciendo el crecimiento de las plantas, cayendo las flores y ocasionando malformaciones en los frutos por esta razón cuando su ataque es intenso la planta muere (Álvarez, Lozano, Martínez, España, & Lara, 2017).
Arañitas rojas, Tetranichus sp (Prostigmata – Tetranychidae)
La familia tetranichidae es una de las más importantes plagas agrícolas que dañan diferentes tipos de cultivos siendo sus estados activos larva, ninfa y adulto, su daño consiste en la remoción del contenido celular, generando clorosis las cuales se van agrandando progresivamente con la población del insecto hasta cubrir la superficie foliar causando la necrosis y caída del órgano vegetal, no causan daño en los elementos conductores del parénquima sin embargo una alta población puede causar la muerte del vegetal (Montoya et al., 2017).
Gorgojo del fréjol, Acanthoscelides obtectus (Coleoptero – Chrysyomelidae) y Zabrotes subfaciatus (Coleoptera – Bruchidae)
La especie Acanthocelides obtectus causa daños en su estado inmaduros por su habito alimenticio de comer semillas en el campo y en almacenamiento llegando a generar pérdidas del 20% hasta el 100% debido también a factores patológicos pues esta especie deja heces e individuos muertos lo cual favorece al crecimiento de hongos, los granos pierden peso, disminuyen su capacidad de germinación, disminuyen su valor nutricional (Ramírez & Suris, 2015).
Por su parte Zabrotes subfaciatus también es una especie que afecta las semillas, esto quiere decir que tiene como hospero principal a Phaseolus vulgaris en su fase de semilla, al igual que la especie Acanthocelides obtectus causa daño en su estado larvario ocasionando daños en los cotiledones, en el caso del adulto deja perforaciones para ubicar sus huevos provocando la pérdida económica de aproximadamente el 35% (Cárdenas, Valdés, Lavastida, & Pozo, 2018)
Minador de la hoja, Lyriomiza sp. (Diptera – Agromyzidae).
Esta especie causa daños en su estado larvario destruyendo irregularmente el mesófilo de las hojas, se dejan notar sus daños unos tres a cuatro días después de la ovoposición, Tanto la forma de extracción de las hojas como el punteado pueden reducir el nivel de fotosíntesis en la planta, también la herida del follaje puede permite la entrada de enfermedades bacterianas y fúngicas (Álvarez, Lozano, Martínez, España, & Lara, 2017).
Mosca blanca, Trialeurodes vaporarium (hemíptero – Aleyrodidae ) y Bemisia toboci (hemíptero – Aleyrodidae)
El daño causado por la especie Trialeurodes vaporarium es causado por las ninfas y los adultos al succionar los nutrientes a través de su aparato bucal, principalmente aminoácidos y azúcares, esto amarillamiento de la planta hospedera, detiene su crecimiento e incluso puede llegar a morir cuando la población del insecto es muy alta (Ortega, 1999).
De igual forma la especie Bemisia toboci ocasiona daños en los cultivos en su estado adulto y de ninfa por su alimentación directa en el floema, los desórdenes fisiológicos causados por el biotipo B y la excreción de maleza que favorece la propagación de hongos y virus, en el frejol se pueden ver decoloraciones, albinismo en los tejidos jóvenes y en las vainas (Cuéllar & Morales, 2006)
Enfermedades
Roya, Uromyces appendiculatus (Pucciniales – Pucciniaceae).
Es considerada una de las principales enfermedades fúngicas del cultivo debido a su distribución a nivel mundial y a la pérdida económica de hasta el 80% que produce pues limita la producción especialmente en climas templados y con periodos húmedos de al menos 10 horas, sus daños ocurren principalmente en prefloración y floración. Este hongo infecta hojas, tallos y vainas, causando mayor daño sobre las hojas, sus síntomas inician con pequeños puntos blancos-amarillentos levantados tanto en el haz como el envés, los cuales crecen formando pústulas de 1 a 2 mm de diámetro, mostrando una gran cantidad de esporas como polvo rojizo (Bernal, Saucedo, & Quintero, 2012).
Ascoquita, Ascochyta sp. (Pleosporales – Didymellaceae).
Es una enfermedad de importancia especialmente en la región andina pues bajo condiciones de alta humedad y temperatura, altitudes mayores a 1500 msnm ocasiones grandes pérdidas económicas, este hongo se disemina por residuos contaminados, salpicadura del agua o por semillas contaminadas. Sus síntomas iniciales aparecen en las hojas, peciolos, pedúnculos, vainas y tallos formando lesiones circulares de color oscuro que al crecer van formando círculos concéntricos donde pueden estar picnidios negros, cuando el ataque es severo puede provocar volcamiento y la muerte del vegetal (Basantes, 2015).
Antracnosis, Collectotrichum lindemutianum (Glomerellales – Glomerellaceae).
Esta enfermedad puede ocasionar perdidas de rendimiento hasta del 95% en regiones con altos niveles de humedad y precipitaciones frecuentes, este hongo afecta principalmente a la calidad de las vainas, peciolos y tallos al inducir lesiones carnosas oscuras que se transforman en chancros hundidos, las semillas pueden presentar decoloración es por esto que se recomienda en campo la utilización de semillas certificadas libres del patógeno, siembra de variedades resistentes y control químico (Martínez, Vanegas, Salazar, Gutiérrez, & Marín, 2014).
Oídio, cenicilla, Erysiphe polygoni (Erysiphales – Erysiphaceae).
Las pérdidas de rendimiento ocasionadas por esta enfermedad pueden ir del 17% al 69% cuando el patógeno infecta antes de la floración siendo favorecido por climas con condiciones de sequía y baja humedad relativa. Los síntomas iniciales son vistos en le haz y envés de las hojas como manchas redondas de color blanquecino, si la enfermedad avanza el micelio puede cubrir a toda la planta empezando a deformar tallos y vainas, es recomendable el uso de semillas certificadas para evitar su diseminación (Peralta, Murillo, Falconi, Mazón, & Pinzón, 2007).
Virus del B C M V, mosaico común (Potyviridae)
Los síntomas que pueden ocasionar esta enfermedad son aparición de mosaico y necrosis sistémica, sin embargo, en ecuador predomina el primer síntoma acompañado por enrollamiento y ampollado en las hojas, cuando la planta está infectada tiene un bajo contenido de vainas y son pequeñas mostrando pequeñas manchas de color verde oscuro. Este virus es transmitido por insectos vectores como áfidos (Peralta, Murillo, Falconi, Mazón, & Pinzón, 2007).
Bacteriosis o tizón común, Xanthomonas campestris pv. Phaseofi (Xanthomonadales – Xanthomonadaceae).
Es una enfermedad de importancia debido a los daños que puede ocasionar y a su distribución mundial, las pérdidas de rendimiento en el cultivo pueden variar de 15% a 30% aunque esto dependerá de las condiciones climáticas durante el ciclo del cultivo y la concentración de inóculos presentes, sus síntomas son visibles en hojas, vainas, tallos (menos común) y semillas apareciendo manchas empapadas de agua que al agrandarse producen un centro necrótico, también esta bacteria puede invadir el xilema. Esta enfermedad es mayormente transmitida por semillas contaminadas razón por la cual se recomienda el uso de semillas certificadas libres del patógeno (Navarrete & Acosta, 2000).
Mancha de Aceite o tizón del halo, Pseudomonas Syringae pv phaseolicola (Pseudomonadales – Pseudomonadaceae).
Es una enfermedad que puede ocasionar perdidas de rendimiento de 43% a 50% presentándose en áreas con temperaturas frías y húmedas cercanas a los 2200 a 2800 msnm, sus síntomas iniciales son vistos a manera de lesiones húmedas de color rojizo en el haz de las hojas, en tallos son alargadas y en vainas son redondas y suelen verse exudados en la lesión. Su diseminación se da por restos de cosecha, semillas contaminadas, movimiento de personas, animales, agua y herramientas (Quiñones, Reyes, Hernández, & Rincón, 2018).
Pudricion de la raíz, Fusarium oxysporum f. sp. Phaseoli (Hypocreales – Nectriaceae) y Fusarium solani f. sp. phaseoli (Hypocreales – Nectriaceae)
Es una enfermedad muy importante para la producción de frejol en el ecuador pues el hongo invade el sistema vascular causando marchitamiento y posteriormente la muerte de las plantas, los síntomas para Fusarium oxysporum f. sp. Phaseoli son amarillamiento en las hojas bajeras, seguidas de las jóvenes, marchitamiento de la planta, puede atrofiar el desarrollo de la planta hasta el punto de no llegar a florecer.
Por su parte Fusarium solani f. sp. Phaseoli sus síntomas inician como lesiones rojizas en la raíz primaria, puede llegar a cubrir a toda la raíz extendiéndose hasta la superficie del suelo, como consecuencia la planta emite raíces adventicias para sobrevivir sin embargo el rendimiento es afectado en la disminución del número y tamaño de las vainas (Peralta, Murillo, Falconi, Mazón, & Pinzón, 2007).
Rhizoctonia solani (Ceratobasidiales – Ceratobasidiaceae)
Esta enfermedad ataca a las raíces de la especie vegetal siendo sus síntomas más característicos las lesiones húmedas de color café rojizo sobre las raíces, al aumentar la infección los chancros también lo hacen uniéndose y alargándose llegando inclusive a matar al hospedero, con frecuencia este hongo afecta a las semillas en la germinación. La enfermedad se desarrolla a temperaturas de 18 a 23 °C y con humedad en el suelo de moderada a alta (Navarrete, Trejo, Navarrete, Prudencio, & Acosta, 2009).
Manejo Agronómico
Resultados
Resultados cultivos
La altura de la planta se presenta en la figura 1 para las diferentes etapas fenológicas del cultivo de fréjol (Phaseolus vulgaris. L) var. Campeón.
En la etapa fenológica inicial presentó una altura media de 5,86 cm, esto ocurrió a los 27 días desde la siembra cuando aparecieron las primeras cuatro hojas verdaderas.
En la etapa de desarrollo desde el crecimiento de las primeras cuatro hojas verdaderas hasta el inicio de la inflorescencia del frejol presentó una altura media de 27,4 cm al cabo de 29 días luego de finalizar la etapa inicial.
En la etapa fenológica mediados de temporada que va del inicio de la inflorescencia hasta comenzar la madurez del cultivo de fréjol, la planta alcanzó una altura promedio de 56,0 cm a 52 días desde la siembra.
Tabla 1. Altura promedio del cultivo por etapa fenológica.
| Altura | Etapa fenológica | |
| 5,68 | 1)Etapa inicial | |
| 27,4 | 2)Etapa de desarrollo | |
| 56 | 3)Etapa intermedia | |

Germinación

El mínimo porcentaje de germinación, según el Sistema de Semillas de Calidad declarada propuesta por la FAO (2003), es de 60% de germinación, por lo que se puede afirmar que presentaron un porcentaje de germinación decente.
Numero de hojas y vainas
En la etapa fenológica mediados de temporada que va del inicio de la inflorescencia hasta comenzar la madurez del cultivo de fréjol, el cultivo presento un promedio de 14,2 vainas por planta y 23,8 hojas por planta a 52 días desde la siembra.
Riego
Sistema de riego por aspersión
Se estableció en la parcela PIS un sistema de riego por aspersión el cual dispone de nueve aspersores a una distancia entre los mismos de 12 m y 13.70 m entre sus laterales de riego; para la recolección de volúmenes se ubicó 72 vasos de 250 mL formando un cuadrante de 3×3 m, registrando así el Vi del medidor de agua por 30 minutos, posteriormente se midió el volumen recolectado de cada vaso para realizar los cálculos pertinentes, se empleó el Software Surfer® para graficar la distribución del agua en la superficie de la unidad experimental.
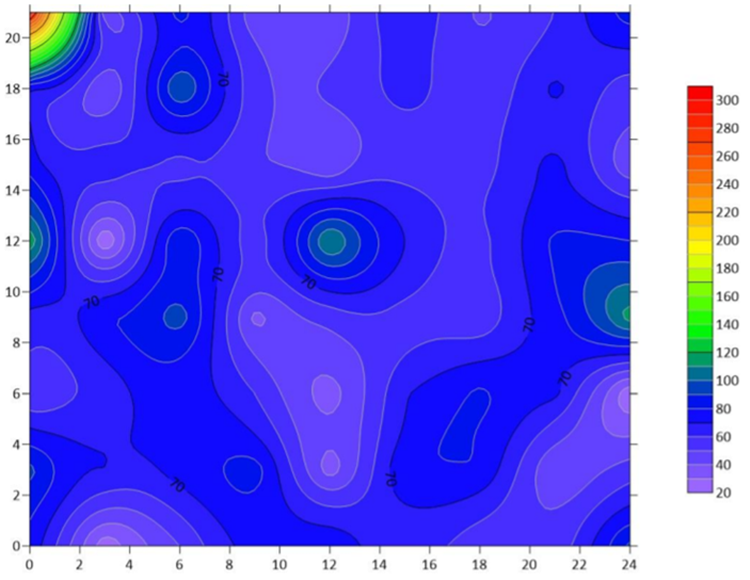
Se muestra de color rojo a naranja exceso de agua en la parcela, azul a verde, buena distribución y morado, denota déficit en el área regada. Estas variaciones en la uniformidad de humedad del suelo pueden atribuirse en este caso a la colocación de los vasos para recolección en lugares donde plantas intervengan o factores como el viento dada su velocidad y dirección según Ortiz (2012).
| Tabla 2. Promedio de los datos aforados (Datos y resultados de los cálculos realizados en la parcela) | |||||
| 𝒏 | 72 | 𝑦̅ | 675.8 | 𝜎 | 341.75 |
| 𝒒𝑷𝒓𝒐𝒎𝟏⁄𝟐 | 479.0 | 𝑞𝑃𝑟𝑜𝑚1⁄4 | 396.7 | 𝑞𝑃𝑟𝑜𝑚1⁄8 | 1237.2 |
| CUC | 70.64 % | CU | 70.88 % | UD | 58.69 % |
| Prom. Unif. | 66.74 % | UEs | 49.43 % | CUa | 56.66 % |
En la tabla se observa que el 50% del promedio de los datos aforados más bajos (los últimos 36 datos) es 21.3, el 25 % del promedio de los datos más bajos (los últimos 18 datos) es 17.6 mientras el 12.5 % del promedio de los datos más altos (los primeros 9 datos) es 46.7.
El resultado final del coeficiente de uniformidad de Christiansen (CUC) es 71.38 % mientras la uniformidad de distribución (UD) alcanzó un 59.23 % y se menciona que la uniformidad abarca tanto al CUC y UD, importante en el campo agronómico dado que los parámetros refieren que el agua distribuida es igual en toda la superficie. Sin embargo, Durand (2017) menciona que la lámina de riego no es del todo uniforme en la unidad experimental bajo un sistema de riego por aspersión.
Promedio de uniformidad obtenido fue 67.43%, según las exigencias en el campo agronómico este porcentaje se considera inaceptable, dado que un sistema de riego por aspersión fijo alcanza un 75% como mínimo exigible.
Resultados Fitopatología Aplicada
En la parcela correspondiente a la siembra de frejol Phaseolus vulgaris var. campeón con densidad de dos semillas por golpe, se pudo identificar por los síntomas presentes en la planta algunas enfermedades como muestra la figura. Sin embargo, las más representativas y que tuvieron mayor incidencia en el cultivo correspondiente al sitio de experimentación fueron roya (Uromyces appendiculatus), antracnosis (Collectotrichum lindemuthianum) y Mancha angular (Phaeoisariopsis griseola).

Roya (Uromyces appendiculatus).
Los síntomas observados en hojas según Borsato, Di Piero, & Stadnik (2010) aparecen al inicio del envés donde se aprecian como pequeños puntos blanco-amarillentos levantados que forman pústulas de 1 a 2 mm de diámetro, posterior a ello la coloración de las pústulas cambian a un color café oscuro y liberan gran cantidad de esporas como polvo rojizo lo cual concuerda con lo observado en las parcelas correspondientes a la variedad campeón.
En el caso de la ecología del patógenoUromyces appendiculatus según Peralta et al. (2007) debido a su fácil diseminación por el viento, es un patógeno del follaje que puede cumplir ciclo en las hojas, ramas y vainas de su principal hospedero, siendo un parasito obligado biótrofo el cual ataca con mayor severidad en los periodos de floración y prefloración del cultivo, aunque también se ha visto presente en otras especies de familias de leguminosas por lo cual se puede mencionar que es un parasito especialista.
La especie aparece en ambientes con temperaturas moderadamente frescas que van de 14 a 17 °C, humedad relativa alta durante 8 a 10 horas y altitudes superiores a 1200 msnm. Con estas condiciones ambientales dadas, el hongo puede causar perdidas de producción del 40 al 46 %, atacando al cultivo desde la tercera semana post siembra (Senasica , 2020). En base a los parámetros dados en la ecología, biología y epidemiologia del patógeno, se pudo analizar y recomendar las siguientes alternativas de manejo presentadas en la tabla.
| Tipo de control | Formas de controlarlo |
| Cultural | Buena preparación del suelo, incorporar al suelo los residuos de plantas enfermas inmediatamente después de la cosecha para evitar la formación de esporas de invierno.Eliminación oportuna de residuos de cosecha Adecuada densidad de plantas y siembra en el momento óptimo para cada territorio.Adecuada fertilización y riego.La rotación de cultivos con cereales como avena o maíz por lo menos durante dos años |
| Genético | Je-Ma, Canario del Chota, Concepción, Canario, Guarandeño, TOA, BolívarINIAP 484 CENTENARIO |
| Biológicos | Extractos acuosos de hojas y flores del Tulipán africano (Spathodea campanulata)Inflorescencia del marpacífico (H. rosa-sinensis) |
| Químico | Benomil 250 g/haBitertanol 250 a 350 cc/haOxicarboxin 600 a 800 g/ha |
Alternativas de manejo presentadas para el hongo de la roya del frejol, entre las diferentes alternativas de manejo se tiene a las labores culturales, genéticos donde se presentan algunas variedades disponibles en el ecuador con resistencia, manejo biológico donde se presentan algunos extractos naturales que suprimen parcial mente al hongo y químicos donde se presenta el ingrediente activo del fungicida y su cantidad por hectárea de terreno.
Antracnosis (Collectotrichum lindemuthianum)
Según León (2009) los síntomas de Collectotrichum lindemuthianum se pueden observar en hojas, tallos, ramas, vainas incluso semillas, en el caso de los síntomas en hojas se presenta una necrosis a lo largo de las nervaduras principales en el envés de la hoja, en tallo y ramas aparecen manchas ovaladas, deprimidas y de coloración obscura, en la vaina y en la semilla las lesiones son chancros deprimidos, de forma redondeada y profunda, en el caso de la parcela evaluada, los síntomas se hicieron presentes en hojas tallos y vainas de la variedad.
La ecología del patógeno Collectotrichum lindemuthianum debido a su diseminación por el viento y especialmente a la capacidad que tiene para cumplir ciclo en los residuos de cosecha, es un patógeno transitorio que puede subsistir en hojas, ramas, tallos, vainas, semillas y plántulas, siendo un parasito facultativo y saprofito facultativo de alimentación necrótrofa el cual ataca con mayor severidad en todos los periodos del cultivo, este patógeno también se ha visto presente en otras especies de familias de leguminosas por lo cual se puede mencionar que es un parasito especialista (Awale, Falconí, & Villatoro, 2008).
Esta especie aparece en ambientes con temperaturas frescas de 13 a 26°C, alta humedad relativa (92-100%), en forma de lluvias moderadas y altitudes superiores a 1000 msnm (León, 2009) ambiente que se encuentra presente en las parcelas correspondientes al sitio de experimentación. En base a los parámetros dados en la ecología, biología y epidemiologia del patógeno, se pudo analizar y recomendar las siguientes alternativas de manejo presentadas en la tabla.
| Tipo de control | Formas de controlarlo |
| Cultural | Hacer rotaciones de frijol con otros cultivos no hospedantes de esta enfermedad, por períodos de dos a tres años, para reducir el nivel de inóculoEliminación de los residuos de cosecha, para reducir también los niveles de inoculoUso de semilla libre o no contaminada por el hongo distanciar las calles de cultivo y orientarlas en dirección norte-sur para favorecer un ambiente seco Evitar el cultivo en zonas de baja exposición solarControlar el desarrollo de malezas durante el cultivo, para favorecer un ambiente más seco en el entorno de la plantaRecurrir a técnicas de acolchado que minimizan el contacto entre la planta y el suelo, incluso para evitar el salpique del suelo al follaje durante la lluviaLimpiar o cambiar los elementos usados en el tutorado del cultivo, si se utilizan |
| Genético | Yunguilla Blanco Fanesquero Libertador Canario Guarandeño BolívarSiteColinasINIAP 484 CENTENARIO |
| Biológicos | fenoles obtenidos del cascalote (Caesalpinia cacalaco)aceite de tomillo |
| Químico | Benomil 250 g/haCarbendaziml 120 a 240 cc/haClorotalonil 700 a 1000 cc/ha |
Alternativas de manejo presentadas para el hongo antracnosis del frejol, entre las diferentes alternativas de manejo se tiene a las labores culturales, genéticos donde se presentan algunas variedades disponibles en el ecuador con resistencia, manejo biológico donde se presentan algunos extractos naturales que suprimen parcial mente al hongo y químicos donde se presenta el ingrediente activo del fungicida y su cantidad por hectárea de terreno.
Mancha angular (Phaeoisariopsis griseola).
Según Tamayo & Londoño (2001) los síntomas que se pueden observar aparecen en hojas y vainas en forma de pequeñas manchas de color gris o café, de forma cuadrada o triangular, con borde amarillento, si la enfermedad persiste se genera una defoliación parcial o total observada en las parcelas de la variedad en estudio, esta defoliación fue vista en algunas plantas, sin embargo, las manchas triangulares fueron vistas en una cantidad mayor dentro de la parcela.
Se transmite principalmente a través de residuos de cosecha y semilla contaminada, es un patógeno transitorio que puede cumplir ciclo en las hojas, tallos, ramas, peciolo, vainas y semillas de su hospedero principal y secundarios, debido a que la mayor severidad de la enfermedad se presenta después de la floración, se consideraba que no había reducciones significativas en el rendimiento mayores al 40 %.
Por otro lado, su mayor desarrollo se observa en temperaturas de 18 a 28 °C, y períodos de lluvia alternados con días secos (Tosquy, López, Becerra, Esqueda, & Rodríguez, 2013), En base a los parámetros dados en la ecología, biología y epidemiologia del patógeno, se pudo analizar y recomendar las siguientes alternativas de manejo presentadas en la tabla.
| Tipo de control | Formas de controlarlo |
| Cultural | Desinfección adecuada del suelo después de cosechar un cultivo afectado por la enfermedad. Identificar las plantas que sirven de hospedero para este hongoRealizar una rotación de cultivos con un tiempo mínimo de dos tiempos entre siembras de fréjolUsar semilla sana y nueva. Eliminar del campo restos de cosechas anteriores muy afectadas. |
| Químico | Benomil 250 g/haFentín 100 a 150 cc/haCloratalonil 700 a 1000 cc/ha |
Alternativas de manejo presentadas para mancha angular del frejol, entre las diferentes alternativas de manejo se tiene a las labores culturales, y químicos donde se presenta el ingrediente activo del fungicida y su cantidad por hectárea de terreno.
Referencias
Aguado, Sánchez, Rubiano, & Sierra. (2020). Principales plagas del fríjol (Phaseolus vulgaris l.) en el Cesar, Colombia. Mosquera, Colombia: Agrosavia.
Álvarez, Lozano, Martínez, España, & Lara. (2017). Insectos presentes en el cultivo de frijol en Zacatecas. Entomología mexicana, 4(1), 55-60.
Alcántar. (2014). La poliploidía y su importancia evolutiva. Temas de Ciencia y Tecnología, 18(54), 17-29.
Angel, M., & Angón, P. (2015). División Celular. 21, 2001–2003.
Auteri, M., Garibotto, M., Nieves, M., Fradkin, M., Giardini, C., Faccio, P., Beznec, A. & Bossio, A. (2019). Caracterización genómica de trigo transgénico (Triticum aestivum L.) utilizando hibridación in situ fluorescente (FISH). Journal of Basic and Applied Genetics, 30(1), 109-122. https://doi.org/10.35407/bag.2019.XXX.01.suppl.06
Awale, Falconí, & Villatoro. (2008). Caracterización de aislamientos de Colletotrichum lindemuthianum de Ecuador y Guatemala para identificar genes de resistencia. Agronomía Mesoamericana, 19(1), 1-6.
Basantes. (2015). Manejo de cultivos andinos del Ecuador. Sangolqui, Ecuador: Universidad de las fuerzas armadas.
Bendaña, A. (2015). Conceptos y principios generales de inmunización. Normas PAI, 15–32. http://www.bvs.hn/Honduras/PAI/ManualNormasyProcedimientos/MNPPAIH1-7.pdf
Bernal, Saucedo, & Quintero. (2012). Alternativas de control a la roya del frijol Uromyces phaseoli (Pers) Wint. var. typica Arth. Las Villas, Cuba: Feijóo.
Borsato, Di Piero, & Stadnik. (2010). Mecanismos de defesa eliciados por ulvana contra Uromyces appendiculatus em três cultivares de feijoeiro. Tropical Plant Pathology, 35 (5), 318-322.
Broughton, Hernandez, Blair, Beebe, Gepts, & Vanderleyden. (2003). Beans (Phaseolus spp.)–model food legumes. Plant and soil, 252(1), 55-128.
BCS (2009). El motocultor: Un auxilio muy eficaz. Laboreo, 54-57.
Calero, A., Castillo, Y., Quintero, E., Pérez, Y., & Olivera, D. (2018). Efecto de cuatro densidades de siembra en el rendimiento agrícola del frijol común (Phaseolus vulgaris L.). Revista de la Facultad de Ciencias, 7(1), 88–100. https://doi.org/10.15446/rev.fac.cienc.v7n1.67773
Cárdenas , Valdés, Lavastida, & Pozo. (2018). Preferencia de Zabrotes subfasciatus por semillas de 23 cultivares de frijol común. Centro Agrícola, 45(4), 27-33.
Cedano, J., De la Rosa, D., Sánchez, A. & Oviedo, F. (2000). Fraccionamiento de nitrógeno en frijol (Phaseolus Vulgaris L.) en el valle de San Juan. Agronomía Mesoamericana, 11(1), 151-154
Cidead. (2011). La célula, unidad de vida. Biología y Geología, 5.2(La célula), 1–61. http://www.cidead.es/mapa/mapcidead.htm
Comai. (2005). The advantages and disadvantages of being polyploid. Nature reviews genetics, 6(11), 836-846.
Cortés, E., Álvarez, F. & González, H. (2009). La mecanización agrícola: gestión, selección, y administración de la maquinaria para las operaciones de campo. Rev. CES, 4(2), 151-160.
Corrales, Villalobos, Vargas, Rodríguez, & Gonzáles. (2017). Principales plagas de artrópodos en el cultivo de Frijol en Costa Rica. Guía ilustrada de artrópodos adultos en campo y grano almacenado. Costa Rica: Fittacori.
Cuéllar, & Morales. (2006). La mosca blanca Bemisia tabaci (Gennadius) como plaga y vectora de virus en fríjol común (Phaseolus vulgaris L.). Revista Colombiana de Entomología, 32(1), 1-9.
Drets, M. (2002). Una saga citogenética: El descubrimiento de los métodos de bandeo cromosómico. Significado y proyección bio-médica. Revista Médica del Uruguay, 18(2), 107-121. http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S1688-03902002000200003&lng=es&tlng=es.
Durand, G. (2017). Evaluación del Coeficiente de Uniformidad de Christiansen en Riego por Aspersión con Línea Lateral Unitaria en el Distrito Huambo, Provincia Caylloma, Región Arequipa [Tesis de pregrado]. Universidad Católica de Santa María.
Escalante, A., Rodríguez, M. & Escalante, E. (2000). Efecto del nitrógeno en la producción y abscisión de órganos reproductivos en el frijol. Agronomía Mesoamericana, 10(1), 47-53
Escobar, S. (2016). Determinación de cariotipo y nivel de ploidía de aguaymanto Physalis peruvianum L [Tesis de Ingeniería-Universidad Nacional del Centro Del Perú], Repositorio Universitario. https://repositorio.uncp.edu.pe/bitstream/handle/20.500.12894/4716/Escobar%20Bendezu.pdf?sequence=1&isAllowed=y
FAO. (2003). Sistema de semillas de calidad declarada. Recuperado de: http://www.fao.org/3/a0503s/a0503s00.htm
Gagneten, A., Imhof, A., Marini, M. del R., Zabala, J. M., Tomas, P., Amavet, P., Revera, L., & Ojea, N. (2015). Biología Conceptos Básico. Universidad Nacional Del Litoral, 1(2004), 1–27. http://www.unl.edu.ar/ingreso/cursos/biologia/wp-content/uploads/sites/9/2016/11/BIO_04.pdf.pdf
García M., E. (2009). Guía técnica para el cultivo de fréjol. IICA-RED SICTA-COSUDE, Nicaragua. 23 p.
González, M. V. (2003). Guía Técnica del cultivo del Ejote o vainita. CENTA. El Salvador. (en línea), consultado el 06 de Julio 2011.
Gómez, A. M. (2019). Análisis de los factores que inciden en las bajas áreas de producción del cultivo de fríjol (Phaseolus vulgaris L.) en el municipio de Manizales.. [Tesis de Ingeniería, Universidad Nacional Abierta y a Distancia UNAD]. Repositorio Institucional UNAD. https://repository.unad.edu.co/handle/10596/25146.
González, Salguero, & Mancía. (1992). Manejo integrado de plagas en frijol (Phaseolus vulgaris L.). En Zapata, & López, Unidades de aprendizaje para la capacitación en tecnología de producción de Fríjol (pág. 257). Cali, Colombia: Centro Internacional de Agricultura Tropical.
Grisi, Blair, Gepts, & Brondani. (2007). Genetic mapping of a new set of microsatellite markers in a reference common bean (Phaseolus vulgaris) population BAT93 x Jalo EEP558. Genet Mol Res, 6(3), 691-706.
Guamán, R., Andrade, C., & Alava, J. (2004). Guia para el cultivo de Frejol enl Litoral ecuatoriano. http://repositorio.iniap.gob.ec/jspui/bitstream/41000/1996/1/iniaplsbd316.pdf
Gutiérrez, L., & Moreno, V. (2005). Análisis de ploidia por citometría de flujo de callos embriogénicos de Aliso andino (Alnus acuminata H.B.K.). Scientia Et Technica, 11(28), 205-209.
Herrera . (2007). La citogenética molecular y su aplicación en el estudio de los genomas vegetales. Agronomía Colombiana, 25(1), 26-35.
León. (2009). La antracnosis y la mancha angular del fríjol común (Phaseolus vulgaris L.). Temas de Ciencia y Tecnología, 13(39), 45-54.
Londoño, J. (2011). Estructura poblacional y diversidad genética de fríjol común (Phaseolus vulgaris L.) en 202 genotipos por medio de SSR fluorescente. Universidad Del Quindío. http://ciat-library.ciat.cgiar.org/articulos_ciat/2011_Estructura%20poblacional%20y%20diversidad%20genetica.pdf
MAGAP. (2005). Principales granos andinos en el Ecuador. Disponible en: www.agroecuador.com/HTML/angendaInter/…/Bibliografia.pdf
MAPA (2016). Motocultores. Ministerio de Agricultura, Pesca y Alimentación. Recuperado de https://www.mapa.gob.es/es/ministerio/servicios/informacion/Motocultores_tcm30-58032.pdf
Martínez, Vanegas, Salazar, Gutiérrez, & Marín. (2014). Detección por PCR de Colletotrichum lindemuthianum en cultivos y semillas de frijol en Antioquia, Colombia. Acta Agronómica, 63(4), 377-387.
Márquez, L. (2012). Los motocultores. Cuaderno de agronomía y tecnología. Agrotécnica. 34-39.
Montoya , Galano, Rodríguez, Franco, Zanardi, & Yamamoto. (2017). Toxicidad de acaricidas sobre Tetranychus urticae (Koch) en laboratorio. Protección Vegetal, 31(1), 60-67.
Morales, E. (2015). Manejo de cultivos andinos del Ecuador. Universidad de las Fuerzas Armadas (ESPE), 9-19
Mudry, M. (2014). Citogenética. Departamento de Ecología, Genética y Evolución, 1-127.
Otto, & Whitton. (2000). Polyploid incidence and evolution. Annual Review of Genetics, 34(1), 401-437.
Navarra (2014). El motocultor y la motoazada. Recuperado de http://www.navarra.es/NR/rdonlyres/3DB3FB4C-51AF-43E8-8E48-81C632265A97/0/04unidad4.pdf
Navarrete, & Acosta. (2000). Genotipos de frijol (Phaseolus Vulgaris l.) resistentes a Xanthomonas campestris pv. phaseoli de México. Agronomia Mesoamericana, 11(1), 17-23.
Navarrete, Trejo, Navarrete, Prudencio, & Acosta. (2009). Reacción de genotipos de frijol a Fusarium spp. y Rhizoctonia solani bajo condiciones de campo e invernadero. Agricultura técnica en México, 35(4), 459-470.
Navarro, G. (2003). El suelo y los elementos químicos esenciales para la vida vegetal. Madrid, España. Química Agrícola
Nuñez, J. & Cruz, T. (2015). Aislamiento, caracterización molecular y evaluación de cepas fijadoras de nitrógeno en la promoción del crecimiento de frijol. Revista Mexicana de Ciencias Agrícolas, 6(5), 929-942
Ortega. (1999). Mosquita blanca vectora de virus en hortalizas. En Anaya , & Romero, Hortalizas: plagas y enfermedades (págs. 149-176). Texcoco. México: Colegio de Postgraduados.
Ortiz-Romero, J. N., Miranda, H. A., & Peroza, D. (2012). Distribución del agua bajo riego por aspersión y su efecto sobre el cultivo de caraota (Phaseolus vulgaris L.). Revista Científica UDO Agrícola, 12(1), 106–116.
Peralta, Murillo, Falconi, Mazón, & Pinzón. (2007). Manual de campo para el reconocimiento y control de las enfermedades más importantes que afectan el cultivo del fréjol Phaseolus vulgaris en Ecuador. Quito, Ecuador: Estación Experimental Santa Catalina INIAP.
Peralta, E., Murillo, I., Villacrés, E. & Pinzon, Z. (2013). Manual agrícola de fréjol y otras leguminosas. Miscelánea No. 135, Quito, Ecuador. INIAP: Programa Nacional de Leguminosas y Granos Andinos
Quiñones, Reyes, Hernández, & Rincón. (2018). Bacteriófagos en el control biológico de Pseudomonas syringae pv. phaseolicola agente causal del tizón de halo del frijol. Ecosistemas y Recursos Agropecuarios, 5(14), 191-202.
Raina, S. N., & Rani, V. (2001). GISH technology in plant genome research. Methods in cell science: an official journal of the Society for In Vitro Biology, 23(1-3), 83–104.
Ramírez, & Suris. (2015). Ciclo de vida de Acanthoscelides obtectus (Say.) sobre frijol negro (Phaseolus vulgaris L.) en condiciones de laboratorio. Protección Vegetal, 30(2), 158-160.
Rodríguez, A., & Frias, S. (2015). La mitosis y su regulación. Acta Pediatrica de Mexico, 35(1), 15. https://www.redalyc.org/pdf/4236/423640345008.pdf
Rodríguez M. (1995). Cariotipo y patrones de bandeo c. en Buffo spinulosus arequipensis. Rev. Ecol. Lat. Am. 2:5-11
Sánchez, E. & Villareal, A. (2013). Obtención de un sucedáneo del café a partir de haba y fréjol tostados. Universidad Central del Ecuador, Facultad de Ingeniería Química, Quito, Ecuador.
Sánchez G. (2011). Diversidad del Maíz y el Teocintle: “Recopilación, generación, actualización y análisis de información acerca de la diversidad genética de maíces y sus parientes silvestres en México”. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Senasica. (2020). Ficha Técnica de Roya del frijol. Ciudad de Mexico: Senasica.
Sistema de Información Pública Agropecuaria (SIPA). (s. f.). Cifras Agroproductivas: Principales Cultivos-2020. Disponible en: http://sipa.agricultura.gob.ec/index.php/cifras-agroproductivas
Taibo, & Ramos. (2020). Fluctuación poblacional de Aphis craccivora y Aphis gossypii sobre Phaseolus vulgaris. Centro Agrícola, 47(1), 55-60.
Tamayo, & Londoño. (2001). Manejo integrado de enfermedades Y plagas del frijol: Manual de campo para su reconocimiento y control. Antioquia, Colombia: Corpoica.
Tosquy, López, Becerra, Esqueda, & Rodríguez. (2013). Reacción a mancha angular y productividad de genotipos de frijol con y sin aplicación de fungicida. Revista mexicana de ciencias agrícolas, 4(1), 167-17.
Ulloa, J., Ulloa, Ramírez, J. & Ulloa, B. (2011). El frijol (Phaseolus vulgaris): su importancia nutricional y como fuente de fitoquímicos. Revista Fuente, 3(8), 5-9
Urbina. (2018). Control de calidad en la producción tradicional y no convencional de semillas de fríjol Phaseolus vulgaris L. El Caribe: Harvest Plus.
Valladolid, A., Blas, R., & Gonzáles, R. (2004). Introducción al recuento de cromosomas somáticos en raíces andinas. Raíces Andinas(6), 96-99.
Velasco, M. J. (2020). Adaptabilidad de 10 variedades de fréjol arbustivo bajo la influencia de la aplicación de Bacillus subtilis [Tesis de Ingeniería, Universidad Central del Ecuador]. Repositorio Institucional-UCE. http://www.dspace.uce.edu.ec/bitstream/25000/21990/1/T-UCE-0004-CAG-285.pdf






Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.