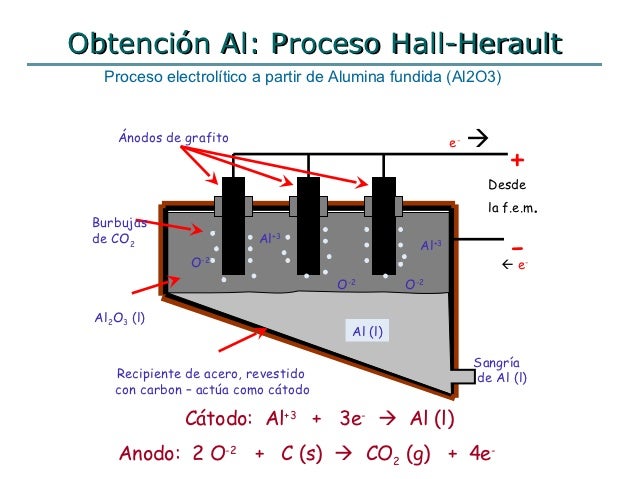
| Ilustración 1 Esquema del proceso Hall-Herault por electrolisis de alúmina fundida en criolita |
El proceso Hall-Heroult en la industria consiste en la utilización de dos tipos de celdas según afirma (Textos Científicos, 2006) poseen múltiples ánodos precocidos y los denominados ánodos de Soderberg; dichos ánodos se encuentran suspendidos de una estructura transversa por encima de la celdas en donde están conectados a una barra colectora anódica, los ánodos precocidos son fabricados a partir de una mezcla de coque de petróleo y alquitrán mediante prensas hidráulicas a 1100 ºC. el ánodo de Soderberg posee un compartimento donde es colocado el electrolito, y la separación entre ánodo y cátodo normalmente es de unos 5cm.
El electrolito utilizado es criolita (3NaF.AlF3) en CaF2 y Al2O3. El punto de fusión de la criolita pura es de 1009 oC, el electrolito contiene espatoflúor (CaF2) y algo de AlF3 en exceso y, junto con la alúmina disuelta, reduce la temperatura de fusión lo suficiente para permitir que las celdas se operen en el intervalo de 940 a 980 oC. El exceso de AlF3 mejora también la eficiencia de la celda. El electrolito se absorbe rápidamente en el recubrimiento y en el aislante, con marcada absorción preferente de una porción con alto contenido de sodio, que tiende al reducir la relación NaF/AlF3 por debajo de lo deseado.
Esto se compensa añadiendo un material alcalino como carbonato de sodio:
3Na2CO3 + 4AlF3 → 2(3Na x AlF3) + Al2O3 + 3CO2
Después de las primeras semanas de operación de las celdas, el electrolito tiende a agotarse en AlF3, por la reacción con la sosa cáustica residual en la alúmina y por la hidrólisis a partir del aire o de materiales añadidos:
3Na2O + 4AlF4 → 2(3NaF x AlF3) + Al2O3
3H2O + 2AlF3 → Al2O3 + 6HF
Las pérdidas en el electrolito requieren adiciones periódicas de AlF3 para mantener la composición deseada. Los resultados finales son la liberación de oxígeno en el ánodo y el depósito de aluminio en el cátodo. Él oxigeno se combina con el ánodo de carbono para formar CO y CO2, predominando el CO2.
Referencia
Textos Científicos. (28 de 12 de 2006). Textos Científicos.com. Obtenido de https://www.textoscientificos.com/quimica/aluminio/obtencion-aluminio-metalico







Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.