Tabla de Contenidos
Introducción
El hidruro de litio es un compuesto inorgánico con fórmula LiH, generalmente de color grisáceo, es una sal obtenida a partir de una reacción de litio fundido con gas hidrógeno en condiciones de alta presión y alta temperatura. Se caracteriza por ser un sólido inflamable y muy reactivo con el agua, de todos los hidruros, el litio es el catión más ligero posible, puesto que el catión hidronio reaccionaría violentamente con el hidruro para formar di hidrógeno, y no se conocen compuestos estables de helio. Una aplicación del hidruro de litio es la batería de ion de litio también conocida como batería Li-Ion, que es un dispositivo diseñado para almacenamiento de energía eléctrica que emplea como electrolito una sal de litio donde consigue los iones necesarios para la reacción electroquímica reversible que tiene lugar entre el cátodo y el ánodo. El ánodo suele ser de grafito, cátodo una aleación de litio (LiFPO4, LiCoO2, LiMn2O4), el electrolito una sal de litio en un disolvente orgánico Y un separador donde generalmente es un polímero poroso. Las propiedades de las baterías de Li-ion ha permitido la generación de pequeños acumuladores de energía adaptados a las aplicaciones de la industria electrónica de gran consumo.
El hidruro de litio (LiH) es un compuesto químico de litio e hidrógeno. Es un sólido cristalino incoloro, aunque las muestras comerciales presentan aspecto grisáceo. Esta sal inorgánica está formada por cationes litio Li+ y aniones hidruro H–, y, como es característico de los hidruros salinos, o iónicos, tiene un alto punto de fusión, de 689 °C. Por la extraordinaria ligereza de sus iones, que resulta en una masa molecular de aproximadamente 8, su densidad es de 780 kilogramos por metro cúbico (kg/m3), la más baja de los compuestos salinos. Tiene una capacidad calorífica estándar de 29,73 J/mol.ºK con una conductividad térmica que varía con la composición y la presión (desde al menos 10 hasta 5 W/mK a 400 K) y disminuye con la temperatura (Nuffiel, 2004).
El anión hidruro en general es muy reactivo frente al aire, al agua y a agentes oxidantes; un catión duro y poco electrón-atrayente como el litio no puede darle la relativa estabilidad que se encuentra, por ejemplo, en el hidruro de zinc. Así, el hidruro de litio es un sólido inflamable y muy reactivo con el agua, produciendo el corrosivo compuesto hidróxido de litio, así como hidrógeno gaseoso (Nuffiel, 2004).
OBTENCIÓN DEL HIDRURO DE LITIO
Se produce por reacción de litio fundido con gas hidrógeno en condiciones de alta presión y alta temperatura. (Bravo, 2007)
2 Li(l) + H2(g) → 2 LiH(s)
MÉTODOS DE OBTENCIÓN
No se encuentra libre en la naturaleza. Se encuentra, formando compuestos, cerca de rocas ígneas y en las aguas de algunos manantiales (Bravo, 2007).
- Se obtiene por electrólisis de cloruro de litio, LiCl, fundido (P. F. 613 ºC)
- Se obtiene por electrólisis de una mezcla de cloruro de litio, LiCl, (45 %) y de cloruro de potasio, KCl, (55 %)
APLICACIONES Y USOS
El hidruro de litio, LiH, tiene numerosos usos (Sharpe, 2010):
- Como precursor para la síntesis de hidruro de litio y aluminio (LiAlH4)
- Generadores de hidrógeno
- Almacenamiento de hidrógeno
- Refrigerante como blindaje en reactores nucleares
- Fabricación de cerámica
- Agente reductor (redox)
De todos los hidruros, el litio es el catión más ligero posible, puesto que el catión hidronio reaccionaría violentamente con el hidruro para formar di hidrógeno, y no se conocen compuestos estables de helio. Puesto que los hidruros de berilio BeH2 y boro B2H6, también muy ligeros y de estequiometria más favorable, son covalentes, el hidruro de litio tiene el más alto contenido de hidrógeno en porcentaje en masa de los hidruros salinos o iónicos. El contenido en hidrógeno del LiH es, por ejemplo, tres veces mayor que el de NaH (aunque su estequiometría es idéntica), lo cual hace que el LiH sea de interés para el almacenamiento de hidrógeno. El compuesto se utilizó en 1967, en el LEX ONERA, en forma de un combustible en grano para cohetes híbridos, denominado Lithergol hipergólico.
BATERÍA DE ION LITIO
La batería de iones de litio, también denominada batería Li-Ion, es un dispositivo diseñado para almacenamiento de energía eléctrica que emplea como electrolito una sal de litio que consigue los iones necesarios para la reacción electroquímica reversible que tiene lugar entre el cátodo y el ánodo. Las propiedades de las baterías de Li-ion, como la ligereza de sus componentes, su elevada capacidad energética y resistencia a la descarga, junto con el poco efecto memoria que sufren o su capacidad para funcionar con un elevado número de ciclos de regeneración, han permitido diseñar acumuladores ligeros, de pequeño tamaño y variadas formas, con un alto rendimiento, especialmente adaptados a las aplicaciones de la industria electrónica de gran consumo. Desde la primera comercialización de un acumulador basado en la tecnología Li-ion a principios de los años 1990, su uso se ha popularizado en aparatos como teléfonos móviles, agendas electrónicas, ordenadores portátiles y lectores de música (Rojas, 2014).
Brevemente recordamos como una celda de una batería de ion-litio constan de:
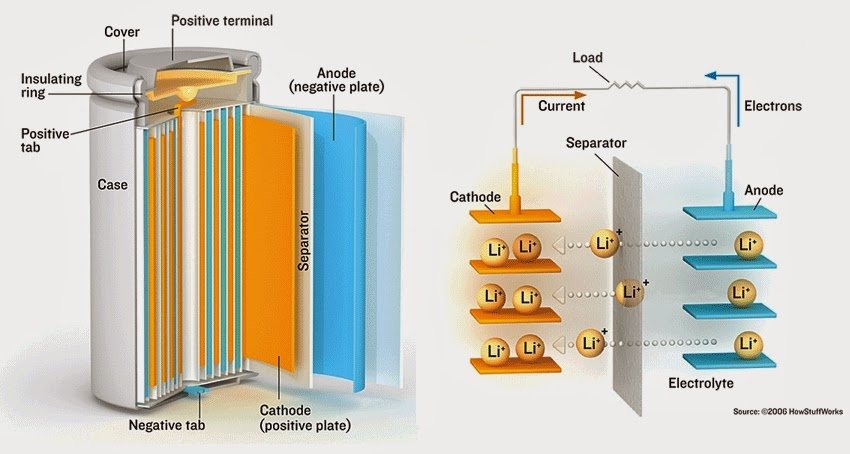
El ánodo; suele ser de grafito
- El cátodo; una aleación de litio (LiFPO4, LiCoO2, LiMn2O4)
- El electrolito; una sal de litio en un disolvente orgánico (un polímero en las baterías de polímero de litio)
- Y un separador; generalmente un polímero poroso

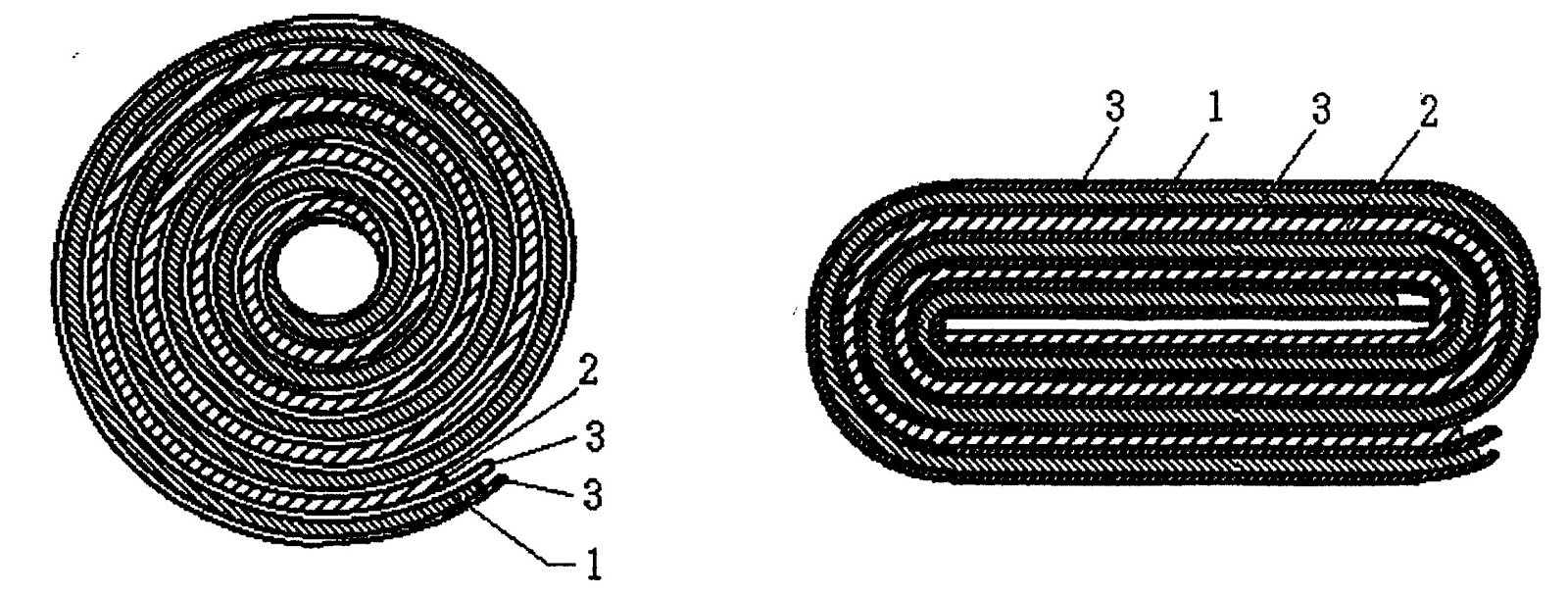
Estos son los principales componentes además del envase, los terminales, aislantes y otros elementos de seguridad. Las celdas usadas pueden ser cilíndricas o prismáticas. En ambos casos se trata de un sándwich enrollado del ánodo, el cátodo y el separador, a los que después se les añade el electrolito.

Durante la carga el litio se desplaza desde el cátodo hasta el ánodo. Al descargarse lo hace en el sentido contrario. Estos procesos van acompañados de reacciones químicas de oxidación y reducción con sus correspondientes balances de electrones. También se producen otras reacciones químicas de las que hablamos en esta entrada.
El hidruro de litio al ser un compuesto covalente, el Li no le da una estabilidad al hidruro, es decir, es muy reactivo con el aire, agua y agentes oxidantes, produciendo hidróxido de litio con alta cantidad de dihidrógeno gaseoso. Así pues sus diversas aplicaciones en la industria para el desarrollo de generadores de hidrógeno y almacenamiento de hidrógeno.
Al analizar sus aplicaciones se ha concluido que una de las utilizadas es en las baterías de litio ya que es un dispositivo ligero para el almacenamiento de energía eléctrica y su resistencia a la descarga, donde se encuentra dos electrodos inmersos en un líquido conductor, este conjunto de elementos forman celdas y la combinación de estas forman la batería, esto activa una reacción química que provoca la circulación de partículas ionizadas de un electrodo a otro y se produce energía eléctrica. Se utiliza especialmente en la industria de la electrónica como en celulares, laptops entre otros.
Bibliografía
Bravo, A. (2007). Tabla periodica en espiral y propiedades zonales. Buenos Aires: Editorial Reverté.
Nuffiel. (2004). Química, Libro del Alumno I. Barcelona: Editorial Reverte.
Rojas, D. (11 de Mayo de 2014). Secura.me. Obtenido de http://www.securamente.com/baterias-de-li-ion-ventajas-desventajas-y-mantenimiento/
Sharpe, A. (2010). Química Inorgánica. Bogota: Editorial Miticos S.A.
- A la muerte de Einstein: efeméride científica 18 de abril
- Américo Vespucio: el explorador y cartógrafo clave en la historia de América
- Descubre la importancia de iNaturalistEc para la ciencia ciudadana y la conservación de la biodiversidad
- Pasta dental, una formulación de la antigüedad
- Extracción de ADN de una muestra vegetal: Kiwi
- Katherine Johnson: La mujer que nos puso en la Luna












Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.